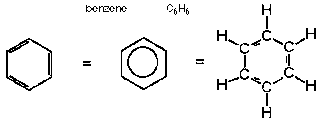
ऐरोमेटिक हाइड्रोकार्बन (aromatic hydrocarbons in hindi) , बेन्जीनॉइड , ऐरोमैटिकता , हकल का नियम
अनुनाद का सिद्धांत
बेन्जीन की अनुनादी ऊर्जा का मान 36 किलो कैलोरी प्रति मोल होता है।
अनुनादी ऊर्जा का मान जितना अधिक होता है , यौगिक का स्थायित्व भी उतना ही अधिक होता है।
ऐरोमैटिकता (aromaticity) : एक चक्रीय समतली निकाय में इलेक्ट्रॉन के विस्थानिकृत द्वारा कुल ऊर्जा कम होने के कारण स्थायीत्व आ जाता है , ये सभी चक्रीय निकाय ऐरोमेटिक निकाय कहलाते है तथा यह परिघटना ऐरोमेटिकता कहलाती है।
ऐरोमेटिकता की आवश्यक शर्तें
- यौगिक चक्रीय होना चाहिए।
- वलय के सभी परमाणु एक ही तल में होने चाहिए।
- अणु असंतृप्त एवं संयुग्मी होना चाहिए।
- वलय के पाई इलेक्ट्रॉन पूर्ण विस्थानीकृत होने चाहिए।
- ऐरोमेटिक यौगिक में प्रेरित वलय धारा होनी चाहिए।
- अणु में योग अभिक्रियाएँ होनी चाहिए।
- दो समीप वाले कार्बन परमाणुओं के बंध का बंध क्रम एक या दो के मध्य होना चाहिए।
- वलय पर वि-स्थानीकृत पाई-इलेक्ट्रॉन की संख्या हकल के नियमानुसार होनी चाहिए।
बेन्जीन के रासायनिक गुण (chemical properties of benzene)
[III] हैलोजन से योग : सूर्य के प्रकाश की उपस्थिति में बेंजीन , क्लोरिन से क्रिया करके बेन्जीन हेक्सा क्लोराइड बनाती है , यह किटनाशक के रूप में काम में आती है।
[IV] इलेक्ट्रॉन स्नेही प्रतिस्थापन अभिक्रिया :
(A) हैलोजनीकरण : प्रकाश की अनुपस्थिति तथा निर्जल FeCl3
या FeBr3 की उपस्थिति में बेन्जीन , Cl या Br (ब्रोमाइड) से क्रिया करके क्लोरो बेंजीन या ब्रोमो बेंजीन बनाती है।
यह प्रतिस्थापन अभिक्रिया बेंजीन का क्लोरीनीकरण या ब्रोमीनीकरण कहलाती है।
(B) नाइट्रिकरण : बेंजीन सान्द्र H2SO4 की उपस्थिति में 50-60 डिग्री सेल्सियस ताप पर सान्द्र HNO3 (नाइट्रिक अम्ल) से क्रिया करके नाइट्रोबेंजीन बनाती है। यह प्रतिस्थापन अभिक्रिया बेन्जीन का नाइट्रिकरण कहलाती है।
इस अभिक्रिया में नाइट्रोनीयम आयन (NO3+) इलेक्ट्रॉन स्नेही अभिकर्मक है।
(C) सल्फोनीकरण : बेंजीन सान्द्र H2SO4 के साथ 80 डिग्री सेल्सियस ताप पर क्रिया करके बेन्जीन सल्फोनिक अम्ल बनाती है , यह प्रतिस्थापन अभिक्रिया बेंजीन का सल्फोनीकरण कहलाती है।
इस प्रतिस्थापन अभिक्रिया में सल्फर डाई ऑक्साइड इलेक्ट्रॉन स्नेही अभिकर्मक है।
(d) फ्रिडल क्राफ्ट अभिक्रिया : निर्जल AlCl3 की उपस्थिति में बेंजीन वलय में एल्किल या एथिल समूह का जुड़ना फ्रिडल क्राफ्ट अभिक्रिया कहलाती है।
(i) निर्जल AlCl3 की उपस्थिति में बेन्जीन मैथिल क्लोराइड से क्रिया करके टोलुइन बनाती है।
(ii) निर्जल AlCl3 की उपस्थिति में बेंजीन , एसिटिन क्लोराइड से क्रिया करके एसीटोफिनोन बनाती है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics