transference definition in hindi in chemistry Transport Number अभिगमनांक को समझाइए
अभिगमनांक को समझाइए क्या है परिभाषा लिखिए transference definition in hindi in chemistry Transport Number ?
अभिगमनांक (Transference or Transport Number)
किसी विद्युत अपघट्य की चालकता उसमें उपस्थित आयनों की संख्या, उनके आवेश तथा उनके वेग पर निर्भर करती है। विद्युत अपघटन में विद्युत धारा धनायनों और ऋणायनों के प्रवाह द्वारा ले जायी जाती है। चूंकि समान विभव प्रवणता (potential gradient ) पर धनायन व ऋणायन की भिन्न-भिन्न गतियाँ होती है अतः किसी भी विद्युत धारा के ले जाने में धनायनों व ऋणायनों की असमान साझेदारी होती है दूसरे शब्दों में किसी विशेष आयन द्वारा ले जाई गई विद्युत धारा का परिमाण उस आयन की गतियों (चाल) के समानुपाती होती हैं। इस तरह ले जाई गई विद्युत धारा की सम्पूर्ण मात्रा दोनों की चालों के जोड़ के समानुपाती होती है।
अतः सम्पूर्ण विद्युत धारा का वह अंश जो किसी आयन द्वारा ले जाया जाता है, उसे आयन का अभिगमनांक (Transport number) या हिटार्फ संख्या (Hitroffs number) कहलाता है। यदि नायन और ऋणायन की गतियाँ क्रमशः व V हो तो दी हुई परिस्थिति में विद्युत अपघटन में प्रवाहित हुई कुल विद्युत धारा (U+ V) के समानुपाती है, अर्थात्
धनायन द्वारा ले जायी गई विद्युत धारा U ………………………….(77)
ऋणायन द्वारा ले जायी गई विद्युत धारा V …………………………(78)
दोनों आयनों द्वारा ले जायी गई सम्पूर्ण विद्युत धारा (U+V) ………………(78)
यदि आयनों की व्यक्तिगत ले जायी गई विद्युत धारा को सम्पूर्ण विद्युत धारा से विभाजित किया जाये तो व्यक्तिगत आयनों द्वारा ले जाई गई विद्युत धारा की मात्रा का अंश प्राप्त होगा। यही उस आयन का अभिगमनांक है।
इस प्रकार कुल विद्युत धारा का धनायन द्वारा ले जाया गया अंश-
= U /U+V ……………………(80)
तथा ऋणायन द्वारा ले जाया गया अंश = V/U + V …………………(81)
इस प्रकार यदि किसी एक आयन का अभिगमनांक ज्ञात हो तो दूसरे आयन का अभिगमनांक सरलता से ज्ञात किया जा सकता है।
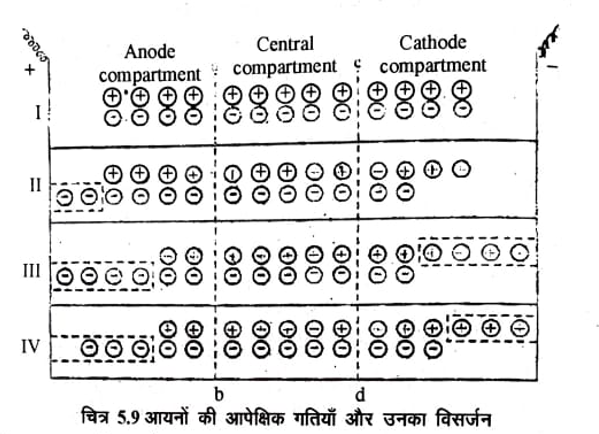
जब किसी विद्युत अपघट्य का विद्युत अपघटन किया जाता है तो धनायनों तथा ऋणायनों की तुल्यांक मात्राओं के मुक्त होने पर भी इलेक्ट्रोडों के निकट विलयन की सान्द्रता में परिवर्तन अलग-अलग पाया जाता है। इस परिवर्तन को हिटार्फ ने 1853 में आयनों के वेग से सम्बन्धित किया इसलिए अभिगमनांक को हिटार्फ संख्या भी कहते हैं। इलेक्ट्रोडों के निकट होने वाले सान्द्रता परिवर्तन और इस परिवर्तन का आयनों के वेग से सम्बन्ध समझाने के लिए चित्र 5.9 पर विचार किजिये ।
चित्र में बताये अनुसार एक विद्युत अपघटनी सैल (Electrolytic cell) को काल्पनिक सरन्ध डायफ्राम द्वारा तीन कक्षों (compartments) में बाँट दिया जाता है। ये कक्ष काल्पनिक विभाजनों ab तथा cd से पृथक किये जाते हैं जिनमें से होकर आयन निकल सकते है। दो बाह्य कक्षों में इलेक्ट्रोड रखे जाते हैं। जिस कक्ष में ऐनोड रखा जाता है उसे ऐनोड कक्ष और जिस कक्ष में कैथोड रखा जाता है उसे कैथोड कक्ष कहते है। बीच वाले कक्ष को मध्य कक्ष कहते है।
कल्पना करें कि इस सैल में विद्युत धारा प्रवाहित करने से पहले विपरीत आवेशित आयनों के 13 युग्म है जिनमें से 4-4 युग्म (चार धनायन व चार ऋणायन ऐनोड और कैथोड कक्ष में है तथा 5 युग्म मध्य कक्ष में है। देखिये 5.9 में स्थिति I) अब इन दोनों इलेक्ट्रोडों के मध्य विभव लगाने पर धनायन कैथोड और ऋणायन ऐनोड की ओर चलते हैं। धनायनों और ऋणायनों की विभिन्न चालों के आधार पर निम्नलिखित स्थितियों पर विचार किया जाता है-
स्थिति II केवल ऋणायन ही अभिगमन करते हैं और धनायन अचल रहते हैं-
विद्युत धारा प्रवाहित करने पर मान लिजिये कि कैथोड कक्ष से केवल दो ऋणायन गति करके डायाफ्राम cd व मध्य कक्ष को पार करके ऐनोड की ओर पहुंच गए है (चित्र 5.9 स्थिति II) | अब कैथोड विभाग में दो धनायनों और दो ऋणायनों (दो जोड़ों) की कमी हुई जबकि ऐनोड कक्ष व मध्य कक्ष में कोई परिवर्तन नहीं हुआ इससे यह स्पष्ट है कि ऋणायन चल (गतिशील) थे तथा धनायन अचल थे फिर भी विपरीत इलेक्ट्रोडों पर धनायनों व ऋणायनों की समान संख्या विसर्जित हुई तथा कैथोड कक्ष में विद्युत अपघट्य की सान्द्रता में कमी हो जाती है। प्रारम्भ में 4 अणुओं से घटकर अन्त में 2 अणु रह जाते है।
स्थिति III जब धनायन और ऋणायन समान गति से चलते हैं
मान लिजिए की दिए हुए समय में दो धनायन बाएं से दाएं कैथोड की ओर चलते हैं और उसी समय में दो ऋणायन दाऐ से बाऐं की तरफ चलेंगे इस स्थिति को चित्र 5.9 स्थिति III द्वारा प्रदर्शित किया गया है। इस स्थिति में भी कैथोड कक्ष में चार अयुग्मित ऋणायन उपस्थित है। इलेक्ट्रोडों पर समान संख्या में आयन (चार – चार) विसर्जित होगें। देखने पर यह पता लगा कि मध्य कक्ष में विद्युतअपघट्य की सान्द्रता में कोई परिवर्तन नहीं होता है तथा एनोड व कैथोड़ कक्ष में दो धनायनों व दो ऋणायनों की कमी हुई अर्थात् दोनों कक्षों का सान्द्रण भी समान सीमा तक कम हो जाता है। अर्थात् दो अणुओं से कम हो गया।
स्थिति VI जब धनायन और ऋणायन विभिन्न गतियों से चलते हैं:- मान लिजिए कि धनायन, ऋणायन की गति से दुगुनी गति से चलते हैं अर्थात् जितने समय में एक ऋणायन कैथोड़ से ऐनोड़ विभाग की तरफ (दांऐ से बांए) पहुँचते है उतने ही समय में दो धनायन ऐनोड़ से कैथोड़ की ओर (बांऐ से दांऐ) पहुँचते हैं। यह स्थिति चित्र 5.9 स्थिति IV द्वारा प्रदर्शित की गई है। इस स्थिति में भी कैथोड़ कक्ष में तीन अयुग्मित धनायन (बिना विपरीत आवेश के) तथा ऐनोड़ कक्ष में भी तीन अयुग्मित ऋणायन अर्थात् समान संख्या के आयन विपरीत इलेक्ट्रोडों पर विसर्जित होते हैं। यह देखा गया है कि मध्य क्ष में विद्युत अपघट्य की सान्द्रता में कोई परिवर्तन नहीं होता है जबकि ऐनोड व कैथोड कक्षों में क्रमशः दो व एक आयानों की कमी हुई। विद्युत अपघट्य की सान्द्रता में कमी ऐनोड में दो तथा कैथोड़ कक्ष में एक अणुओं से कम हो गई।
उपरोक्त विवेचन से निम्नलिखित निष्कर्ष निकाले जा सकते हैं।
(i) मध्य कक्ष में विद्युत अपघट्य की सान्द्रता में कोई परिवर्तन नहीं हुआ ।
(ii) आयन सदैव तुल्यांकी मात्रा में विसर्जित होते है भले ही उनकी गति कुछ भी हो।
(ii) किसी भी इलेक्ट्रोड कक्ष में (इलेक्ट्रोड के चारों ओर) सान्द्रण में होने वाली कमी उससे परे (दूर विपरीत इलेक्ट्रोड की तरफ) चलने वाले आयन की गति की समानुपाती होती है। अतः
(iv) किसी भी इलेक्ट्रोड पर मुक्त होने वाले पदार्थ की मात्रा दोनों इलेक्ट्रोड़ों के चारों ओर उपस्थित विद्युत अपघट्य की सान्द्रता में होने वाली कमियों के जोड़ के बराबर होती है।
5.34.5 दुर्बल अम्ल एवं दुर्बल क्षारों के वियोजन स्थिरांक निर्धारित करना ( Determination of Dissociation constants of Weak Acids and Weak Bases) – माना कि दुर्बल अम्ल (HA) की वियोजन की मात्रा ∝ तथा अम्ल की सान्द्रता C मोल प्रति लिटर हो तो साम्यावस्था पर समीकरण को निम्न प्रकार से लिख सकते हैं-
5.35 चालकता मूलक अनुमापन (Conductometric Titrations )
अनुमापनों में चालकता मापन द्वारा अन्तिम बिन्दु (end point) के ज्ञात करने की विधि को चालकता मूलक अनुमापन (Conductometric titration) कहते है। कोलराऊश के नियमानुसार किसी विलयन की तुल्यांकी चालकता उपस्थित आयनों की संख्या एवं उनकी गतिशीलता पर निर्भर करती है। जब अनुमापन किया जाता है तो अनुमापन (Titrant) के आयन अनुमाप (Titre) के आयनों से क्रिया करके दुर्बल विद्युत अपघट्य अथवा बहुत कम घुलने वाले पदार्थ बनाते है। उदाहरण के लिये अम्ल तथा में H+ +OH ⇒ H2O व KCI तथा AgNO3 के अनुमापन में Ag++ CI ⇒ AgCI अभिक्रिया होती है। इस प्रकार हटाये गये आयनों के स्थान पर दूसरे आयन आ जाते है। जिससे अनुमापन मिश्रण की चालकता में अन्तर आ जाता है। अन्तिम बिन्दु से पहले तथा बाद में विलयन की चालकता में परिवर्तन की प्रवृति अलग-अलग होती है। अतः ग्राफ द्वारा अन्तिम बिन्दु निकाला जाता है। अनुमापन में अनुमापक की विभिन्न मात्रायें तथा चालकता में ग्राफ खींचा जाता है।
चालकता मूलक अनुमापन चालकता सेलों में किया जाता है। किसी एक विलयन का निश्चित आयतन उचित चालकता सेल में लिया जाता है। इसमें दूसरा विलयन जिसकी सान्द्रता सैल में लिये गए विलयन की सान्द्रता से लगभग पाँच गुना अधिक होती है, को ब्यूरेट की सहायत से थोड़ा मिलाया जाता है और विलयन मिलाने के बाद हर बार चालकता मापी (Conductivity bridge) से विलयन की चालकता मापी जाती है। जैस- जैसे अन्तिम बिन्दु पास आता जाता है ब्यूरेट से डालने वाले विलयन की मात्रा कम करते जाते है । अन्तिम बिन्दु के पास केवल 0.1 मिली. विलयन डालकर ही चालकता मापते हैं। मापी गई चालकता में तनुता प्रभाव (Dilution effect) के कारण संशोधन किया जाता है। माना कि प्रेक्षित चालकता C है अनुमाप का आयतन V तथा अनुमापक की मात्रा का आयतन v हो तो
‘
यहाँ C’ संशोधित चालकता है। संशोधित चालकता व मिलाये गए अनुमापक के आयतन के मध्य एक ग्राफ खींचने पर एक बिन्दु पर मिलती हुई दो सीधी या लगभग सीधी रेखाएं प्राप्त होती है। प्रतिच्छेद बिन्दु अनुमापन का अन्तिम बिन्दु बताता हैं। ग्राफ से इस बिन्दु का संगत आयतन ज्ञात करके अज्ञात विलयन की सान्द्रता का मान ज्ञात किया जाता है। –
सामान्य अनुमापनों में तनुता प्रभाव संशोधन की आवश्यकता नहीं पड़ती क्योंकि अनुमापन मिश्रण में अधिक वृद्धि नहीं होने पाती ।
अब यहाँ हम दो प्रकार के अनुमापनों का वर्णन करेंगे।
(i) अम्ल क्षार अनुमापन (Acid Base Titration)
(ii) अवक्षेपण अनुमापन (Precipitation Titration)
5.35.1 अम्ल क्षार अनुमापन (Acid Base Titration)-
(अ) प्रबल अम्ल का प्रबल क्षार से अनुमापन- जब किसी प्रबल अम्ल (HCI, H2SO4 आदि) का किसी प्रबल क्षार (NaOH, KOH आदि) के साथ अनुमापन किया जाता है। तो यह माना जाता है कि विलयन में पूर्णतया वियोजित होते हैं (चूंकि दोनों प्रबल है)। इनकी क्रिया को निम्नानुसार निरूपित किया जा सकता है
अम्ल का विलयन चालकता सेल में लिया जाता है और क्षार को ब्यूरेट में प्रारम्भ में HCI विलयन की चालकता H’ तथा CH- आयनों के कारण होती है। जैसे जैसे NaOH विलयन इसमें मिलाया जाता है तो अधिक गतिशीलता वाले H+ OH- आयनों से क्रिया करके H2O बनाते हैं तथा H’ आयन हटते जाते है और उनके स्थान पर मन्द गतिवाले Na+ आयन आते है जैसा कि समीकरण से स्पष्ट है। इस प्रकार अनुमापन मिश्रण की चालकता कम होती जाती है। NaOH और अधिक डालने पर चालकता और कम होती जाती है जैसा कि चित्र 5.12 (a) में सरल रेखा AB से स्पष्ट है। अन्तिम बिन्दु के बाद और NaOH मिलाने पर चालकता में वृद्धि होती है। यह वृद्धि अनुमापन मिश्रण में OH की मात्रा बढ़ने के कारण होती है। जैसा कि सरल रेखा DC द्वारा दिखाया गया है AB तथा CD सरल रेखाओं को पीछे की ओर बढ़ाने पर वे एक दूसरे को X पर काटती हैं। अतः X बिन्दु अन्तिम बिन्दु है । इस बिन्दु के समतुल्य NaOH की मात्रा सेल में लिये गए HCI को उदासीन करने के काम आयी ।
(ब) प्रबल अम्ल का दुर्बल क्षार से अनुमापन माना कि प्रबल अम्ल HCl तथा दुर्बल क्षार NH4OH का अनुमापन करने पर इस क्रिया को निम्नानुसार निरूपित किया जा सकता है-
इस अनुमापन में भी HCI चालकता सेल में लिया जाता है तथा NH, OH ब्यूरेट से डाला जाता है। इस अनुमापन में H+ जिनकी गतिशीलता अधिक है NH4जिनकी गतिशीलता कम है द्वारा विस्थापित होते है। फलस्वरूप अनुमापन मिश्रण की चालकता में कमी होती जाती है। जैसा कि चित्र 5.12 (b) में सरल रेखा AB द्वारा दिखाया गया है।
अन्तिम बिन्दु के पश्चात NH4OH डालने पर अनुमापन मिश्रण की चालकता में वृद्धि नगण्य होती है। यह इसलिये होता है कि NH, OH दुर्बल क्षार है अर्थात् इसके आयनन की मात्रा बहुत कम है अतः विलयन में मुक्त OH- आयन नहीं मिल पाते। यह सरल रेखा CD द्वारा स्पष्ट है। AB और CD सरल रेखा एक दूसरे को X बिन्दु पर काटती है अतः यह अन्तिम बिन्दु है ।
(स) दुर्बल अम्ल का प्रबल क्षार से अनुमापन- जब दुर्बल अम्ल जैसे ऐसीटिक अम्ल और प्रबल क्षार जैसे NaOH का अनुमापन किया जाता है जो अभिक्रिया निम्नानुसार है।
CH3COOH + Na+ + OH ⇒ CH3COO+ Na+ + H2O
अम्ल को चालकता सेल में तथा क्षार को ब्यूरेट में लिया जाता है। दुर्बल अम्ल होने के कारण इसकी चालकता कम होगी जब इसमें NaOH डाला जाता है तो उच्च आयनन वाला प्रबल विद्युत अपघट्य CH3COONa बनता है। अतः विलयन में Na’ की मात्रा बढ़ने के कारण अनुमापन मिश्रण की चालकता बढ़ जाती है। इस प्रकार और अधिक NaOH डालने पर चालकता में वृद्धि होती जाती है जैसा कि चित्र 5.12 (c) में सरल रेखा AB द्वारा दिखाया गया है अन्तिम बिन्दु के पश्चात् अधिक मात्रा में NaOH डालने पर विलयन में OH- की मात्रा बढ़ती जाती है, अतः विलयन की चालकता में बहुत तेजी से वृद्धि होती है जैसा कि चित्र में सरल रेखा CD द्वारा दिखाया गया है। दोनों रेखायें X बिन्दु पर एक दूसरे को काटती है अतः X बिन्दु अन्तिम बिन्दु है।
(द) दुर्बल अम्ल का दुर्बल क्षार से अनुमापन- जब दुर्बल अम्ल (CH3COOH) व दुर्बल क्षार (जैसे NH, OH) का अनुमापन किया जाता है तो अभिक्रिया निम्न प्रकार होती है-
प्रारम्भ में चालकता कम होती है क्योंकि CH, COOH दुर्बल है। NH OH मिलाने पर उच्च चालकता वाला CH3COONH4 बनता है अतः विलयन की चालकता बढ़ती है चित्र 5.12 (d) । अन्तिम बिन्दु के बाद NH, OH मिलाने पर चूंकि दुर्बल विद्युत अपघट्य होने के कारण इसका आयनन बहुत ही कम होता है, अतः चालकता में बहुत कम परिवर्तन होता है जैसा कि चित्र में सरल रेखा CD द्वारा दिखाया गया है। दोनों रेखाऐं X बिन्दु पर एक दूसरे को काटती है अतः X बिन्दु अन्तिम बिन्दु है।
5.35.2 अवक्षेपण अनुमापन (Precipitation Titrations) – अवक्षेपण अनुमापनों में उदाहरणार्थ AgNO3 और KCI की अभिक्रिया को ले सकते है जो निम्नानुसार है-
चालकता सेल में AgNO3 विलयन की चालकता Ag’ तथा NO, आयनों की उपस्थिति के कारण होती है। KCI मिलाने पर Ag+ आयनों के स्थान पर K+ आयन आ जाते हैं। लेकिन Ag+ तथा K+ की गतिशीलता (चालकताएँ) लगभग बराबर है अतः अनुमापन मिश्रण की चालकता में कोई विशेष परिवर्तन नहीं होता है जैसा कि चित्र 5.12 (e) में सरल रेखा AB द्वारा दिखाया गया है। अन्तिम बिन्दु के पश्चात् KCI डालने पर चालकता में वृद्धि मुक्त CI- मिलाने के कारण होती है जो कि सरल रेखा CD द्वारा दिखाया गया हैं। दोनों सरल रेखायें X बिन्दु पर मिलती है, अतः यह अन्तिम बिन्दु है।
5.36.3 चालकता मूलक अनुमापनों का लाभ- चालकता मूलक अनुमापनों के निम्नलिखित लाभ हैं-
(1) तनु विलयनों का अनुमापन किया जाता है
(2) रंगीन विलयन जैसे रंजक द्रव्य (dye Stuff) का अनुमापन किया जा सकता है, जिसमें अन्तिम बिन्दु निर्धारित करने में साधारण सूचक का उपयोग नहीं कर सकते हैं।
(3) प्रबल व दुर्बल अम्लों के मिश्रण का भी (HCl + CH3COOH) अनुमापन इस विधि द्वारा किया जा सकता है ।
(4) दुर्बल क्षार व दुर्बल अम्ल का अनुमापन चालकता मूलक अनुमापनों द्वारा किया जा सकता है। क्योंकि साधारण आयतन -मितिय विश्लेषण में ऐसे अनुमापन सूचकों के साथ तीक्ष्ण रंग परिवर्तन नहीं होता ।
(5) इस विधि में अन्तिम बिन्दु ग्राफ द्वारा निर्धारित किया जाता है, अतः अन्तिम बिन्दु के पहले और बाद में कुछ ही मापन पर्याप्त है और अन्तिम बिन्दु पर साधारण अनुमापन की तरह कोई सावधानी नहीं रखनी पड़ती है। प्राप्त परिणाम अधिक यथार्थ होते हैं ।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics