धातुओं को संक्षारण से बचने के दो उपाय बताइए prevention from corrosion in hindi
prevention from corrosion in hindi धातुओं को संक्षारण से बचने के दो उपाय बताइए ?
संक्षारण (Corrosion)
यह वह प्रक्रिया है जिसमें धातुऐं वायुमण्डल में उपस्थित गैसें हवा तथा नमी से क्रिया करके अवांछित पदार्थ (सामान्यतः ऑक्साइड) बनाते हैं जिसमें धातुओं की क्षति होती है। सोना, प्लेटिनम तथा पैलेडीयम के अलावा लगभग सभी धातुएं वायुमण्डल से क्रिया करती है जिससे इनका संक्षारण (Corrosion) होता है। उदारहणार्थ चाँदी पर हल्के भूरे काले रंग की परत जमना, पीतल व तांबे पर नीली हरी परत का जमना, सीसा, तथा स्टील की चमक (Lusture) का कम होना, लोहे पर जंग लगना आदि संक्षारण (Corrosion) के उदाहरण है तथा संक्षारण से धातु की क्षति होती है ।
अतः धातु व मिश्र धातु के सतह का वायुमण्डलीय कारकों के द्वारा शनैः शनै विनाश या क्षय होना संक्षारण कहलाता है। वायुमण्डलीय कारक जैसे जल, वातावरण में उपस्थित गैसें व अन्य क्रियाशील द्रव माध्यम धातु की सतह पर रासायनिक क्रिया करते हैं जिसके फलस्वरूप धातु ऑक्सीकृत होकर ऑक्साइड, हाइड्रॉक्साइड, कार्बोनेट, सल्फेट आदि यौगिक बनाती है
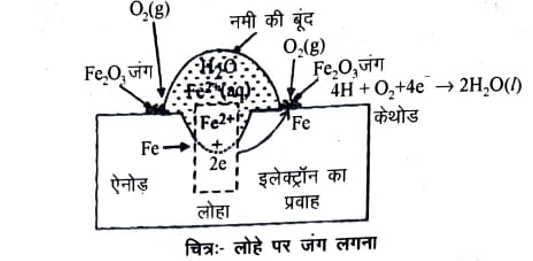
लोहे के संक्षारण को जंग लगना (Rusting) कहते हैं। जंग को रासायनिक रूप में हाइड्रेटेड फैरिक ऑक्साइड Fe2 O3xH2O कहते हैं। वायुमण्डल में उपस्थित नमी, कार्बन डाई ऑक्साइड तथा ऑक्सीजन (हवा) के कारण लोहे पर जंग लगता है ।
संक्षारण के प्रकार (Types of Corrosion) :- वायुमण्डल या वातावरण ( Environment) में संक्षारण दो प्रकार के होते है जो निम्न है-
(i) गैसीय वायुमण्डलीय द्वारा संक्षारण (Corrosion by gaseous environement) (ii) द्रवों या विलयनों द्वारा संक्षारण (Corrosion by liquids or solutions)
“(i) गैसीय वायुमण्डल द्वारा संक्षारण:- इसमें धातु तथा वायुमण्डल में उपस्थित ऑक्सीकारक पदार्थ की रासायनिक अभिक्रिया के कारण संक्षारण होता है।
इस प्रकार के संक्षारण में धातु पारिपार्श्विक (वातावरण) में उपस्थित गैसों से घिरी रहती है। इसके कारण निम्न दो प्रभाव होते हैं-
(a) धातु कम हो जाती है तथा (b) धातु के गुण परिवर्तित होते हैं।
गैसीय वातावरण द्वारा संक्षारण के सिद्धान्त (Theory of Corrosion by Gaseous Environment):-
इस सिद्धांत के निम्न अभिग्रहित है-
(i) धातु में वायुमण्डलीय गैस अणु परमाणु या आयन के रूप में विलयन बनाते हुये घुलती है इसे धातु में गैस का विसरण कहते हैं।
(ii) सतह पर अभिक्रिया द्वारा उत्पाद पदार्थ का बनना उदाहरणार्थ- ऑक्सीजन के कारण ऑक्साइड फिल्म, H2S गैस के कारण सल्फाइड फिल्म तथा CO2 के कारण कार्बोनेट फिल्म का बनना सतह पर तीन प्रकार के संक्षारण उत्पाद बनते हैं- (a) सतह पर बनने वाला पदार्थ अस्थायी हो-
इस स्थिति में संक्षारण नहीं होगा ऐसा प्लेटिनम पर होता है।
(b) बनने वाला पदार्थ उच्च ताप पर वाष्पशील हो इस स्थिति में संक्षारण अधिक होगा ऐसा मोलिब्डनम व टंगस्टन में होता है।
(c) बनने वाला पदार्थ स्थायी हो सामान्य प्रकार की धातुओं पर इस प्रकार का संक्षारण होता है।
इस प्रकार के संक्षारण में उत्पाद फिल्म जो धात्विक सतह को पूरी तरह से ढ़कती है वह एक सरंध फिल्म (Porous film) बनाती है जो गैस के विसरण में काम आती है। इसी प्रकार उत्पाद फिल्म असरंध्र (Non Prous) फिल्म बनाती है जो कुछ मोटाई तक ढ़कती है। तथा तीसरे प्रकार की वह फिल्म जो टूट (Crack) जाती है।
(ii) द्रवों या विलयनों द्वारा संक्षारण (Corrosion by liquids or solutions ) :- इसमें धातु तथा पारिपार्श्विक के मध्य वैद्युत् रासायनिक या रासायनिक अभिक्रिया के द्वारा संक्षारण होता है। इसे निमज्जी संक्षारण (Immersed corrosion) कहते हैं। ये तीन प्रकार के होते हैं-
(1) रासायनिक संक्षारण (Chemical Corrosion) :- धातु तथा उसके चारों ओर द्रव के कारण वैद्युत रासायनिक अभिक्रिया द्वारा होता है।
इस संक्षारण में कई ऐसे कारक हैं जो संक्षारण की दर को प्रभावित करते हैं। जैसे लवण की सान्द्रता, निमज्जीत गहराई (Depth of immersion), घुली हुई ऑक्सीजन की मात्रा, तापक्रम माध्यम के धनायन व ऋणायन की मात्रा, संक्षारण के दौरान बनने वाले पदार्थ की प्रकृति, संक्षारण माध्यम की वैद्युत् चालकता, PH, कोलाइड़ों की उपस्थिति आदि ।
(2) जल के द्वारा संक्षारण (Under water corrision) :- इस प्रकार का संक्षारण पानी के द्वारा होता है। जैसे पानी के नल में जंग लगना, पानी को गर्म करने पर बर्तन में तथा भाप बायलर आदि में होता
है ।
(3) भूमिगत संक्षारण (Under ground corrosion) :- भूमिगत पानी के नल के ऊपर, तथा सीमेन्ट कन्करीट में लोहे का संक्षारण होता है।
द्रवों या विलयनों का संक्षारण सिद्धांत (Theory of Corrosion by Liquids or solutions):-
इसके लिए वैद्युत रासायनिक सिद्धान्त (Electrochemical Theory) महत्वपूर्ण है जिसका विवरण निम्न है। सामान्यतः इस सिद्धान्त को लोहे पर जंग लगने के सिद्धान्त से समझते हैं-
वैद्युत रासायनिक सिद्धान्त में ऑक्सीकरण व अपचयन प्रक्रिया होती है। इस सिद्धान्त के अनुसार यह माना गया कि धातु की असमान (Uniform) सतह या लोहे में उपस्थित अशुद्धियाँ ऑक्सीजन घुलित जल या कार्बन डाई ऑक्साइड की उपस्थिति से एक प्रकार के छोटे वैद्युत सेल जिसको संक्षारण युग्म (Corrossion Couple) कहते हैं, बनाते हैं। धातु की सतह पर कई जगह नमी में घुली हुई ऑक्सीजन की फिल्म वैद्युत अपघटन विलयन की परत बनाती है।
इन छोटे वैद्युत अपघटन सेल में शुद्ध आयरन ऐनोड व अशुद्धियाँ कैथोड की तरह कार्य करती है। अतः जंग लगने में निम्न पद कार्य करते हैं-
(i) प्रत्येक सेल के ऐनोड़ पर ऑक्सीकरण होता है तथा ऐनोड़ पर उदासीन आयरन परमाणु ऑक्सीकृत होकर Fe2+ बनाता है व इलेक्ट्रॉन निकालता है।
Fe(s) —→ Fe2+ + 2e ऐनोड़ पर ……(68)
(ii) प्रत्येक सेल के कैथोड पर इलेक्ट्रॉन हाइड्रोजन द्वारा ग्रहण करके अपचयन होता है यह H आयन जल या जल में उपस्थित अम्लीय पदार्थों से लेता है।
इसमें निकली हाइड्रोजन कैथोड़ पर इकट्टी होती जाती है तथा ध्रुवण उत्पन्न करती है व संक्षारण को रोकती है। लेकिन वायुमण्डलीय ऑक्सीजन विध्रुवण (Depolariser) का कार्य करती है।
4 H+ (aq) + O2(g) + 4e → 2H2O (/) ……………………..(69)
अतः रेडाक्स अभिक्रिया (i) व (ii) को जोड़ने पर
2Fe(s) + 4H++ O2 → 2Fe2+(aq) + 2H2O ………………..(70)
इसमें (70) में बने Fe2+ आयन वायुमण्डलीय ऑक्सीजन से ऑक्सीकृत होकर जंग (Rust) बनाते
हैं।
इसी प्रकार Fe2+ आयन विलयन में उपस्ति OH- आयनों से क्रिया करके
Fe2+ + 20H → Fe (OH)2
यह फैरस हाइड्रॉक्साइड वायुमण्डल में उपस्थित कार्बन डाई ऑक्साइड व ऑक्सीजन से क्रिया करके बेसिक कार्बोनेट बनाता है।
अतः संक्षारण प्रक्रिया एक वैद्युत रासायनिक प्रक्रिया है जिसमें ऐनोड़ व कैथोड़ धातु की सतह पर बनते हैं तथा वैद्युत अपघटय (जल, अम्ल या लवण का विलयन) सतह पर रहता है जो आयनिक प्रवाह (lonic flow) को होने देता है जिससे संक्षारण पदार्थ बनते हैं।
जंग सतह को नहीं बचाता है बल्कि ऑक्सीजन निकालने के कारण और अधिक संक्षारण में मदद करता है।
वैद्युत रासायनिक श्रेणी में जो तत्व श्रेणी में ऊपर है उसका अधिक संक्षारण होगा क्योंकि ये अपने से नीचे स्थित धातुओं के लिए ऐनोडीय व्यवहार प्रदर्शित करती है। जबकि जो नीचे है उसका कम क्योंकि ये कम सक्रिय होने के कारण ये आसानी से इलेक्ट्रॉन नहीं त्यागती है। ये अपने से ऊपर स्थित धातुओ के लिये केथोडीय व्यवहार प्रदर्शित करती हैं। ऐल्यूमिनीयम (E° = – 1.66 वोल्ट) जो आइरन (E° = 0.44 वोल्ट) से ऊपर है का संक्षारण अधिक होना चाहिए लेकिन एल्यूमीनीयम का संक्षारण कम होता है कारण कि एल्यूमीनीयम वायुमण्डलीय ऑक्सीजन से क्रिया करके सतह पर ऑक्साइड फिल्म बनाती है जो ओर अधिक संक्षारण को रोकती है।
यह देखा गया कि लवण के जलीय विलयन में संक्षारण अधिक होता है इसका कारण लवण के जलीय विलयन में वैद्युत चालकता अधिक होती है।
इसी प्रकार क्लोराइड आयन जंग लगने की प्रक्रिया में उत्प्रेरक का कार्य कर जंग प्रक्रिया को बढ़ा देते हैं।
अतः समुद्री पानी व सड़क पर बर्फ को पिघलने के लिए नमक डालते है वहाँ धातु पर जंग का लगना एक ज्वलंत समस्या है।
इसी कारण समुद्र के किनारे रखे जहाज जंग के कारण जल्दी क्षतिग्रस्त हो जाते हैं।
संक्षारण की रोक (Prevention from Corrosion) :- संक्षारण एक धात्विक सतह प्रक्रिया है अतः धातु का संक्षारण रोकने के लिए सतह प्रक्रिया को रोकना आवश्यक है। ज्यादातर लोहा व स्टील काम में लेते हैं व इन पर जंग लगता है अतः जंग को रोकने के लिए निम्न विधियाँ अपनाते हैं।
(1) अवरोधी रक्षण (Barrier Protections ) :- इसमें धातु व वायुमण्डलीय ऑक्सीजन के मध्य एक अवरोधी पदार्थ लगा दिया जाता है जो इस प्रकार है-
(i) धात्विक सतह पर वार्निश या पेन्ट से पेन्ट कर दिया जाए।
(ii) धात्विक सतह पर तेल या ग्रीस की पतली सतह लगा दी जाए। यह प्रक्रिया सामान्यतः औजार पर करते हैं।
(ii) धातु की सतह पर टीन, निकल, जिंक, क्रोमियम आदि धातुओं को परत विधि द्वारा परत चढ़ा दी जाए। वैद्युत लेपन (Electroplating)
(2) सतह का रक्षण (Sacrifical Protection) :- आइरन से अधिक सक्रिय धातु से आइरन की सतह को लेप कर देने से आइरन का संक्षारण बहुत ही कम हो जाता है। संक्षारण के बचाव के लिए आइरन पर यह लेप जस्ते द्वारा किया जाता है। इस प्रक्रिया को गेल्वेनीकरण (Galvanization) कहते हैं। जो इलेक्ट्रॉन निकलते हैं उनको रोकते हैं। Zn का ऑक्सीकरण विभव Fe के ऑक्सीकरण विभव से अधिक है । अतः Zn की उपस्थिति में केवल Zn का ऑक्सीकरण होता है Fe का ऑक्सीकरण नहीं होता है। इस प्रकार Zn की परत एक बलिदानी परत (Sacrifical coating) का कार्य करती है। अतः लोहे के पाइप पर जस्ते की परत चढ़ाते है जिसे गेल्वेलाइल्ड पाइप कहते हैं।
इसी प्रकार स्टेनलैस स्टील में आइरन के साथ क्रोमीयम व निकिल भी होता है । ये मिश्रण धातुऐं भी संरक्षी परत बनाकर आयरन का संक्षारण से बचाव करती है। इसी प्रकार गोल्ड, प्लेटीनम के अपचयन विभव अधिक होते है अतः वायु और जल की उपस्थिति में इनका संक्षारण नही होता है ।
वातावरण में उपस्थित अवांछित पदार्थों को हटाकर या आवश्यक पदार्थों को मिलाकर संक्षारण के प्रभाव को कम किया जा सकता है । ताप व सान्द्रता को कम करके भी संक्षारण को रोका जा सकता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics