potentiometric titration in hindi definition types विभव मूलक अनुमापन किसे कहते हैं
विभव मूलक अनुमापन किसे कहते हैं potentiometric titration in hindi definition types ?
सान्द्रता सेल (Concentration Cells)
जैसा कि हम पढ़ चुके हैं, सेल का वि. वा. बल अन्य कारकों के अतिरिक्त विद्युत अपघट्य की सान्द्रता पर भी निर्भर करता हैं। यदि अन्य कारक समान रखे जायें तो विद्युत अपघट्य अथवा इलेक्ट्रोड की सान्द्रता में परिवर्तन करके भी सेल बनाये जा सकते हैं। सान्द्रता सेल में विद्युत ऊर्जा वि.वा.बल पदार्थ के तत्त्व के उच्च सान्द्रता क्षेत्र से निम्न सान्द्रता के क्षेत्र में स्थानान्तरण द्वारा उत्पन्न होती है। ये सेल सान्द्रता सेल कहलाते हैं सान्द्रता सेल के दोनों इलेक्ट्रोड पर रासायनिक अभिक्रियाये होती है, परन्तु एक इलेक्ट्रोड पर होने वाली अभिक्रिया दूसरे इलेक्ट्रोड (अर्ध सेल) पर होने वाली अभिक्रिया की ठीक विपरीत रासायनिक परिवर्तन द्वारा संतुलित होती है। अतः सेल में कोई शुद्ध रासायनिक अभिक्रिया (net chemical recation) नहीं होती है। भिन्न-भिन्न सान्द्रताओं के इलेक्ट्रोडों अथवा विद्युत अपघटयों की सान्द्रता समान होने में सन्निहित प्रक्रमों में होने वाले भौतिक परिवर्तन यानि की पदार्थ का उच्च सान्द्रता से निम्न सान्द्रता की ओर स्थानान्तरण ही इस प्रकार के सेलों में विद्युतवाहक बल उत्पन्न करता है।
सान्द्रता सेलों को दो भागों में बांटा जा सकता है-
(i) इलेक्ट्रोड सान्द्रता सेल (Electrode Concentration Cells)
(ii) विद्युत अपघट्य सान्द्रता सेल (Electrolyte Concentration Cells)
इलेक्ट्रोड सान्द्रता सेल :-
इस प्रकार के सेल में दो समान इलेक्ट्रोड, जिनकी सान्द्रतायें अर्थात् सक्रियतायें भिन्न-भिन्न हो, एक ही विद्युत अपघट्य अर्थात् अपने ही आयनों के विलयन में डूबे रहते हैं। इस विद्युत अपघट्य में अपघट्य पदार्थ के आयन उपस्थित रहते हैं। इन सेलों के इलेक्ट्रोड अमलगम इलेक्ट्रोड या गैस इलेक्ट्रोड होते हैं- उदाहरण के लिये सिल्वर अमलगम के दो इलेक्ट्रोड जिनकी सक्रियतायें a1 व a2 है, को सिल्वर नाइट्रेट विलयन के सम्पर्क में रखा जाता है। चित्र 6.8 इस सान्द्रता सेल को निम्न रूप से व्यक्त करते हैं.
सान्द्रता सेलों में E° का मान हमेशा शून्य होगा क्योंकि तब प्रत्येक इलेक्ट्रोड की सक्रियता इकाई होगी तो दोनों इलेक्ट्रोड समान हो जायेगें तथा उनके विभव भी समान होंगे, अतः इलेक्ट्रोडों के मध्य विभवान्तर शून्य (E° = 0) होगा
यदि गैसीय इलेक्ट्रोड हों तो सक्रियताओं के स्थान पर गैसों के दाब लिये जाते है H2 (g) सान्द्रता सेल को निम्न प्रकार निरूपित किया जाता है-
सान्द्रता सेल विभव की गणना करने की एक अन्य विधि भी है। इसे निम्न सेल द्वारा समझा जा सकता है।
लवण सेतु (Salt Bridge)
जब दो अर्ध सेलों को सम्पर्क में लाया जाता है तो इन दोनों के विलयन सीधे सम्पर्क में नही रहे इसके लिए लवण सेतु का उपयोग किया जाता है। सामान्य प्रायोगिक कार्यों के लिए द्रव-द्रव सगंम विभव को विलुप्त या कम किया जा सकता है। चित्र 6.9 के अनुसार लवण सेतु बनाने के लिए उल्टी U आकार की नली होती है। जिसमें ऐसे विद्युत अपघट्य का विलयन लिया जाता है जिसके धनायनों एवं ऋणायनों की गतिशीलताऐं लगभग समान हो। इसके लिए उपयुक्त विद्युत अपघट्य पोटेशियम क्लोराइड (KCI) अथवा अमोनियम नाइड्रेट (NH4NO3 ) का संतृप्त विलयन लेते हैं। लवण सेतु में U नलिका में अगर-अगर नामक पदार्थ को संतृप्त KCI या NH4NO3 के साथ जैल (Agar-Agar Gel) बना कर नली में भर दिया जाता है और ठण्डा किया जाता हैं नलिका के दोनो मुंह को रूई या कांच की रुई (glass wool) से बन्द कर देते हैं। जिससे अधिक विसरण को रोका जा सके। तथा इस U नली को (चित्र 6.9) के अनुसार दोनों अर्ध सेलों के बीच रखा जाता है।
इसमें से होकर केवल इलेक्ट्रॉन ही गमन कर सकते है आयनों का गमन इनमें से होकर नहीं होता। इसके उपयोग से द्रव संधि विभव का विलोपन इसलिए हो जाता है कि एक विलयन और सेतु विलयन के मध्य विकसित हुआ विभव तथा दूसरे विलयन और सेतु विलयन के मध्य विभव परिमाण के बराबर पर चिन्ह में विपरीत होने के कारण लगभग नष्ट हो जाते हैं। इसे सेतु के रूप में निम्न प्रकार से दो खड़ी समानान्तर रेखाओं द्वारा प्रदर्शित करते हैं।
Zn|Zn2+ || Cu2+|Cu
लवण सेतु
विद्युत अपघट्य सान्द्रता सेल (Electrolyte Concetration Cells) :
इस प्रकार से सेल में दो इलेक्ट्रोड अपने आयनों के दो भिन्न-भिन्न सान्द्रता अथवा सक्रियता के विलयनों में डूबे रहते हैं। विद्युत अपघट्य की सान्द्रता भिन्न-भिन्न होने के कारण ही इलेक्ट्रोडों पर भिन्न-भिन्न विभव उत्पन्न होते हैं और सेल में विभान्तर उत्पन्न होता है। विद्युत अपघट्य सान्द्रता सेलों को दो भागों में विभाजित किया जा सकता है।
(a) अभिगमन रहित विद्युत अपघट्य सान्द्रता सेल या जब दोनों विलयन सीधे सम्पर्क में नही हो (Concentration Cells Without Transference) -: इस प्रकार के सेल में विद्युत अपघट्य के दोनों विलयन एक दूसरे के सीधे सम्पर्क में नही होते। दोनों विलयन लवण सेतु (Salt bridge) द्वारा सम्पर्क में रहते है, इसलिए इलेक्ट्रोड पदार्थ का एक इलेक्ट्रोड से दूसरे इलेक्ट्रोड की ओर स्थानान्तरण नहीं होता। इसके साथ ही इस प्रकार के सेल में द्रव द्रव संगम (liuqid-liquid junction) नहीं होता और न ही द्रव-द्रव संगम विभव (liquid-liquid junction potential) उत्पन्न होता है।
इस प्रकार के सेल का निर्माण निम्न प्रकार से किया जा सकता है।
यहां a+ तथा a_ क्रमशः H+ तथा CI की सक्रियतायें है। जो कि HCI विलयन में उपस्थित है।
a. इन आयनों की माध्य सक्रियता (mean activity) है।
ऐसे दो सेलों को विपरीत दिशा में युग्मित करके एक संयुक्त सेल बनाया जा सकता है जिसमें HCI विलयनों के माध्य सक्रियतायें क्रमशः (a.)1 तथा (a.)2 हों। संयुक्त सेल निम्न होगा।
इस सेल की सम्पूर्ण अभिक्रिया दोनों घटक सेलों की अभिक्रियाओं को जोड़कर प्राप्त की जा सकती
सम्पूर्ण सेल अभिक्रिया से स्पष्ट है कि कोई शुद्ध रासायनिक क्रिया नहीं हो रही है। केवल HCI जिसकी माध्य सक्रियता (a)) है (a), माध्य सक्रियता के HCI मे परिवर्तित हो रहा है। नेर्स्ट समीकरण का उपयोग करके उपरोक्त से वि.वा.बल का व्यंजक लिखा जा सकता है। यह ध्यान रखना की सान्द्रता सेलों का मानक सेल विभव (E°cell) शून्य होता हैं।
एक सामान्य विद्युत अपघट्य जिसमें v तथा + _क्रमशः धनायन तथा ऋणायन हो, v कुल आयन तो समीकरण (i) को व्यापक रूप मे इस प्रकार लिखा जा सकता हैं ।
(+) अथवा (-) चिन्ह तथा v+ अथवा v- का उपयोग इस पर निर्भर करता है कि बाह्य इलेक्ट्रोड क्रमशः धनायन अथवा ऋणायन के प्रति उत्क्रमणीय है। यदि विद्युत अपघट्य की माध्य सक्रियता ज्ञात न हो तो माध्य सक्रियताओं को सक्रियताओं में परिवर्तन किया जो सकता है । समीकरण (ii) को निम्न प्रकार से लिखा जा सकता है।
(b) अभिगमन युक्त सान्द्रता सेल या जब दोनों सेल सीधे सम्पर्क में हो (Electrolyte Concentration Cell with Transference): –
इस प्रकार के सेल में दो समान इलेक्ट्रोड भिन्न-भिन्न सान्द्रताओं में होते हैं, परन्तु उनके मध्य एक रंध्रमय विभाजन लगा होता है ताकि विलयन आपस में मिश्रित न हों। इस सेल में विद्युतधारा प्रवाहित होने पर पदार्थ अधिक सान्द्रता से कम सान्द्रता की ओर स्थानान्तरित होता है, जिसके फलस्वरूप दोनों द्रवों के संधि स्थान पर विभवान्तर उत्पन्न होता है। इस प्रकार सेल में इलेक्ट्रोड विभव व द्रव – द्रव संगम विभव उत्पन्न होते हैं। द्रव – द्रव संगम विभव को द्रव -संधि विभव भी कहते हैं। द्रव संगम युक्त एक सेल का आरेख निम्न प्रकार लिख सकते हैं।
इस सेल का विभव, इलेक्ट्रोड विभवों तथा द्रव संगम विभव द्वारा निर्धारित किया जाता है, तथा नेट सेल अभिक्रिया इलेक्ट्रोडों और द्रव संगम पर होने वाली अभिक्रियाओं का योग होगी । चित्र 6.10 में उपरोक्त सेल का एक रेखाचित्र दिखाया गया है।
इस सेल में होने वाले विभिन्न अभिक्रियाओं को निम्न प्रकार लिखा जाता है।
इलेक्ट्रोड अभिक्रियायेंः
द्रव-द्रव संगम अभिक्रिया (Liquid Liquid Junction Reaction) : यदि सेल में एक फैराडे विद्युतधारा प्रवाहित की जाती है तो ग्राम तुल्यांक H+(a+)1, बांयी ओर से दाहिनी ओर द्रव संगम को दाहिनी ओर से बांयी ओर द्रव संगम को पार करते हैं।t तथा ग्राम तुल्यांक Cl-(a-)2 ओर से बांयी ओर द्रव संगम को पार करते हैं।यहां t तथा t क्रमश: H’ तथा CI- के अभिगमनांक (Transport number) है। यह ध्यान रखना आवश्यक है कि H+ का अभिगमन बांयी ओर से दाहिनी ओर इसलिये होता है क्योंकि Ht दाहिनी ओर के इलेक्ट्रोड पर निक्षेपित (discharge) होते हैं।
अतः द्रव संगम पर होने वाली अभिक्रिया इस प्रकार लिखी जा सकती है।
नेट सेल अभिक्रिया : नेट सेल अभिक्रिया ज्ञात करने के लिये नेट इलेक्ट्रोड अभिक्रिया ( 35 )a तथा द्रव संगम अभिक्रिया (36) तथा (37) को जोड़ने पर-
यह सेल अभिक्रिया प्रदर्शित करती है कि जब सेल में 1 फैराडे विद्युत धारा की मात्रा प्रवाहित हो है तो t_ ग्राम तुल्यांक HCl उच्च सक्रियता (a)2 से निम्न सक्रियता (a.) की ओर स्थानान्तरित होता है । नेर्स्ट समीकरण द्वारा इस सेल का विभव इस प्रकार लिखा जा सकता है-
व्यंजक धनायन के प्रति उत्क्रमणीय इलेक्ट्रोड़ों से बने सेलों के लिये है। यदि सेल ऋणायन के प्रति उत्क्रमणीय इलेक्ट्रोड़ों से बना हो उदाहरण के लिये निम्न सेल मैं-
Ag|AgCl(s) | HCl(a.) ] | HCl(a) 2 | AgCl(s)| Ag
समीकरण (38) व (39) में जिन आयनिक स्पिशीज के अभिगमनांक समायोजित है, उन आयनों के अनुसार इलेक्ट्रोड उत्क्रमणीय है। सामान्यतः जब विद्युत अपघट्य में v+ धनायन तथा v_ ऋण आयन हो तब
व्यापक रूप से सेल विभव निम्न समीकरण द्वारा व्यक्त किया जाता है-
यहां v = (V+ +v ) है तथा n उस आयन की संयोजकता है जिसके प्रति इलेक्ट्रोड उत्क्रमणीय है। समीकरण (40) सेल के विभव के माध्य सक्रियताओं के रूप में व्यक्त करती हैं
यदि विद्युत अपघट्य की माध्य सक्रियता ज्ञात हो तो उन्हें सक्रियता द्वारा निम्न प्रकार प्रतिस्थापित किया जाता हैं ।
समीकरण (41) द्वारा अभिगमन युक्त सान्द्रता सेल के विभव या वि.वा.बल की गणना की जा सकती।
द्रव संगम विभव रहित सान्द्रता सेल (Concentration Cells without liquid junction Potential)
अभिगमन युक्त सान्द्रता सेल में यदि अभिगमन को रोक दिया जाये तो सेल का द्रव संगम विभव विलुप्त (eliminate) हो जाता है। अतः सेल का निम्नलिखित आरेख प्राप्त हो जाता है।
यहां (a_)2> (a_)1 है तथा दोनों अर्द्धसेलों को लवण सेतु द्वारा जोड़ा गया है। इस सेल में होने वाली इलेक्ट्रोड अभिक्रियाओं को निम्न प्रकार लिखा जाता है-
र्स्ट समीकरण द्वारा इन सान्द्रता सेल का वि.वा. बल निम्न प्रकार लिखा जा सकता है ।
किसी भी धनायन अथवा ऋणायन की सक्रियता ज्ञात नहीं की जा सकती अतः विद्युत अपघट्य की माध्य सक्रियता को लगभग आयन की सक्रियता माना जा सकता है, अर्थात् aa समीकरण (42) में ये मान प्रतिस्थापित करने पर –
धन चिन्ह इलेक्ट्रोडों के धनायन के प्रति उत्क्रमणीय तथा ऋण चिन्ह इलेक्ट्रोडों के ऋणायन के प्रति उत्क्रमणीय होने की स्थिति में उपयोग होता है । n उस आयन की संयोजकता है, जिसके प्रति इलेक्ट्रोड उत्क्रमणीय है ।
द्रव सगम विभव का परिकलन (Determination of Liquid Junction Potential)
अभिगमन युक्त सान्द्रता सेल
का विद्युतवाहक बल समीकरण (38) द्वारा दिया जाता है-
सान्द्रता सेलों के अनुप्रयोग (Application of Concentration Cells)
1 (1) आयनों की संयोजकता का निर्धारण (Determination of Valancy of Ions) नर्स्ट समीकरण द्वारा सान्द्रता सेल के लिए
सान्द्रता सेलों में E° का मान हमेशा शून्य होता है क्योंकि जब प्रत्येक इलेक्ट्रोड की सक्रियता इकाई होगी तो दोनों इलेक्ट्रोड समान हो जायेगें तथा उनके विभव भी समान होंगे, अतः इलेक्ट्रोड़ों के मध्य विभवान्तर शून्य होगा ।
यहाँ n धनायन की संयोजकता को बताता है या सेल अभिक्रिया में काम आने वाले इलेक्ट्रॉनों की संख्या है
2 अल्प विलेय लवणों की विलयेता का निर्धारण (Determination of Solubitity of Sparingly Soluble Salt) किसी विलयन की आयनिक सान्द्रता की गणना सान्द्रता सेल के वि.वा. बल से की जा सकती है। अल्प विलेय के सम्बध में यह माना जा सकता हैं कि पदार्थ संतृप्त विलयन में भी पूर्णतः आयनिक हैं अतः आयनिक सान्द्रता लवण की विलेयता के समानुपाती है। इसके लिए सान्द्रता सेल को इस प्रकार बनाते है। कि एक विलयन की सान्द्रता ज्ञात है तथा दूसरा अल्प विलेय लवण बना संतृप्त विलयन है। इसमें इलेक्टोड इस प्रकार होती है की ये संतृप्त विलयन के धनायन या ऋणायन के प्रति उत्क्रमणीय होती है। माना कि अल्प विलेय लवण सिल्वर क्लोराइड विलयन की विलेयता ज्ञात करनी है तो इसके लिए निम्न सेल होगा
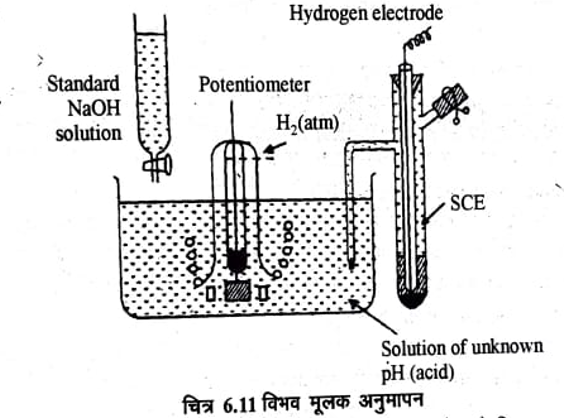
विभव मूलक अनुमापन (Potentiometic Titrations)
अनुमापनों में विद्युत वाहक बल के मान द्वारा अन्तिम बिन्दु के ज्ञात करने की विधि को विभव मूलक अनुमापन (Potentio metric titrations) कहते हैं।
इसमें किसी उपयुक्त इलेक्ट्रोड को अनुमापक विलयन में रखकर अनुमाप्य (titirant) मिलाने पर इसके इलेक्ट्रोड विभव में जो अन्तर आता है उसको नापते है तथा अन्तिम बिन्दु पर वि.वा.बल में तीव्रता में परिवर्तन होता है। अब अनुमाप्य विलयन के आयतन को वि.वा.बल के विपरीत आलेखित कर परिवर्तनीय बिन्दु (Inflexion point) ज्ञात कर लेते हैं।
इसमें जो उपयुक्त इलेक्ट्रोड काम में लेते है उसे सूचक इलेक्ट्रोड (indicator electrode) कहते हैं। उदाहरणार्थ अम्ल क्षार अनुमापनों में हाइड्रोजन इलेक्ट्रोड या कांच के इलेक्ट्रोड को सूचक इलेक्ट्रोड मानकर एवं कैलोमल इलेक्ट्रोड को एक संदर्भ इलेक्ट्रोड (Refrence electrode) की तेरह प्रयोग करते हुए उपयोग कर सकते हैं।
विभव मूलक अनुमापन की श्रेष्ठता (Advantage of Potentiometric Titrations) साधारण सूचक विधि की तुलना में यह विधि कई बातों में श्रेष्ठ है-
(1) इसका उपयोग दुर्बल अम्लों और दुर्बल क्षारों के पारस्परिक अनुमापनों के लिए भी किया जा सकता है जिसके लिए उपयुक्त सूचक उपलब्ध नहीं है।
(2) इसका उपयोग रंगीन विलयनों जैसे सिरका स्याही के साथ भी किया जा सकता है। जिनका सूचकों की सहायता से अनुमापन करना असंभव है।
(3) इसका अवक्षेपण अनुमापन में भी उपयोग करते हैं।
(4) इसमें ऑक्सीकरण अपचयन अनुमापनों में बाह्य सूचकों की कोई आवश्यकता नहीं रहती ।
सूचक इलेक्ट्रोड – सूचक इलेक्ट्रोड जो सामान्य रूप से काम में लेते हैं
(1) कांच इलेक्ट्रोड
(2) क्विन हाइड्रोजन इलेक्ट्रोड
( 3 ) टंगस्टन या मॉलीब्डनम इलेक्ट्रोड
(4) हाइड्रोजन इलेक्ट्रोड आदि ।
1 अम्ल क्षार अनुमापन (Acid Base Titration) अम्ल क्षार के उदासीनीकरण में हमेशा H’ या OH- आयनों के सान्द्रण में परिवर्तन होता है अतः
इस अनुमापन में हाइड्रोजन इलेक्ट्रोड का उपयोग करते हैं तथा N – केलोमल इलेक्ट्रोड को संदर्भ इलेक्ट्रोड के रूप में काम में लेते हैं। pH में परिवर्तन के कारण सेल के वि.वा.बल में परिवर्तन होगा। किसी हाइड्रोजन इलेक्ट्रोड का विभव निम्न समीकरण द्वारा व्यक्त करते हैं।
यहाँ E° मानक इलेक्ट्रोड विभव है जो हाइड्रोजन इलेक्ट्रोड के लिए शून्य होता है।
अम्ल क्षार अनुमापन के लिए प्रयोग में लाने वाला उपकरण चित्र 6.11 में दिखाया गया है। हाइड्रोजन या कांच इलेक्ट्रोड H तथा केलोमल इलेक्ट्रोड को अनुमापित किए जाने वाले विलयन (अम्ल) में डुबोते हैं। तथा इस निर्मित सेल को विभवमापी (Potentiometer) से जोड़ देते हैं तथा वि.वा. बल माप लेते हैं। अब ब्यूरेट में से मानक क्षार विलयन को धीरे-धीरे डालते हैं।
क्षार डालने के बाद हर बार विलयन को अच्छी तरह से हिलाकर सेल के वि.वा.बल को माप लेते हैं अब अनुमापक विलयन के आयतन को वि.वा.बल के विपरीत आलेखित कर लेते हैं। अन्तिम बिन्दु पर वि.वा.बल में एकदम परिवर्तन हो जाता है। आलेखित करने पर चित्र 6.12 (a ) प्राप्त हुआ।
सही अन्तिम बिन्दु ज्ञात करने के लिए V/Ε को अनुमापक के आयतन के विपरीत आलेखित करने पर चित्र 6.12(b) के अनुसार वक्र प्राप्त होता है जिसमें उच्चतम बिन्दु अन्तिम बिन्दु होता है।
2 ऑक्सीकरण अपचयन अनुमापन (Oxidation Reduction Titrations ) :- ऑक्सीकरण अपचयन अनुमापनों में अन्तिम बिन्दु का निर्धारण भी इस विधि द्वारा किया जाता है। उदाहरणार्थ फेरस सल्फेट विलयन को बीकर में लेकर ब्यूरेट में लिए हुए मानक पोटेशियम डाइक्रोमेट के विरूद्ध अनुमापन करते हैं। अम्ल क्षार अनुमापन की भाँति इसमें भी अन्तिम बिन्दु पर वि.वा.बल में एकदम परिवर्तन होता है।
3 अवक्षेपण अनुमापन (Precipitation Titrations ) :- माना कि सिल्वर नाइट्रेट के विलयन का मानकीकरण करना चाहते हैं इस स्थिति में सिल्वर इलेक्ट्रोड को सूचक के रूप में प्रयुक्त करते हैं। इसके अर्द्ध सेल Ag+|Ag का विभव केलोमल इलेक्ट्रोड के साथ जोड़कर ज्ञात कर सकते हैं। सिल्वर नाइट्रेट के विलयन को मानक पोटेशियम क्लोराइड के विलयन के विरूद्ध अनुमापन करते हैं। Ag+ आयन AgCI के रूप में अवक्षेपित होता है जिससे Ag+ आयन की सान्द्रता कम होती जाती है तथा Ag+ Ag इलेक्ट्रोड
का विभव भी लगातार KCI मिलाने पर कम होता जाता है तथा अन्तिम बिन्दु पर इलेक्ट्रोड विभव में बहुत अधिक परिवर्तन होता है तथा अन्तिम बिन्दु के बाद भी KCI मिलाने पर इलेक्ट्रोड विभव में अन्तर बहुत कम होता है। इसमें भी अम्ल क्षार की भाँति विभव मूलक वक्र प्राप्त होता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics