Classification of Electrochemical Cells in hindi विद्युत रासायनिक सेलों का वर्गीकरण
विद्युत रासायनिक सेलों का वर्गीकरण क्या है Classification of Electrochemical Cells in hindi ?
सेल विभव के अन्य उपयोग (Other Application of Cell Potential)
पूर्व के खण्ड़ों में अर्द्धसेल विभव के कुछ उपयोग जैसे अभिक्रियाओं के साम्य स्थिरांक की गणना, सक्रियता गुणांक ज्ञात कना आदि का अध्ययन किया गया है। इस खण्ड में कुछ अन्य उपयोगों का अध्ययन करेगें ।
1 pH का निर्धारण (Determination of pH):- हाइड्रोजन आयनों की सान्द्रता व्यक्त करने का एक सुगम मापक्रम pH मापक्रम है। इसके अनुसार
अर्थात् हाइड्रोजन आयनों की सान्द्रता का ऋणात्मक लोगिरिथम pH कहलाता है।
जिस विलयन का pH ज्ञात करना होता है उसमें हाइड्रोजन आयन के प्रति उत्क्रमणीय इलेक्ट्रोड तथा एक संदर्भ इलेक्ट्रोड जोड़ कर सेल बनाया जाता है। इस सेल का वि.वा.बल पोटेन्श्योमीटर द्वारा मापा जाता है तथा इलेक्ट्रोड विभव समीकरण द्वारा pH की गणना की जाती है। सामान्तया सन्दर्भ इलेक्ट्रोड केलोमल इलेक्ट्रोड लेते हैं। हाइड्रोजन आयन के प्रति उत्क्रमणीय इलेक्ट्रोड के रूप में, हाइड्रोजन इलेक्ट्रोड, क्विनहाइड्रोन इलेक्ट्रोड अथवा कांच का इलेक्ट्रोड उपयोग में लिये जाते हैं।
(i) हाइड्रोजन इलेक्ट्रोड का उपयोग हाइड्रोजन इलेक्ट्रोड
इस इलेक्ट्रोड का संतृप्त केलोमल इलेक्ट्रोड के साथ युग्मन करके निम्नलिखित सेल बनाया जाता
उपरोक्त सेल का वि.वा.बल (Ecell) को पोटेन्शियोमीटर द्वारा ज्ञात करते हैं, संदर्भ इलक्ट्रोड का विभव (Ecal) ज्ञात है, अतः pH के मान की गणना की जा सकती है।
(ii) क्विनहाइड्रोजन इलेक्ट्रोड का उपयोग :- क्विनोन (C6H4O2) तथा हाइड्रोक्विनोन [C6H4(OH)2] का समअणुक (equimolecular) यौगिक क्विनहाइड्रोन कहलाता है। यह एक शिथिल रासायनिक योगिक होता है। जिस विलयन का pH ज्ञात करना होता है, उसे क्विनहाइड्रोन से संतृप्त करके एक अक्रिय इलेक्ट्रोड (Ptअथवा Au) डुबो दिया जाता है। इस इलेक्ट्रोड को एक संदर्भ इलेक्ट्रोड (संतृप्त केलोमल इलेक्ट्रोड) के साथ युग्मित करके बने सेल का वि.वा. बल ज्ञात कर लेते हैं।
इस प्रकार Ecell ज्ञात करके pH की गणना की जाती है। यह इलेक्ट्रोड उन विलयनों के लिये उपयोग में नहीं लाया जा सकता जिनके pH का मान 8 से अधिक हो । अधिक क्षारीय विलयनों में हाइड्रोक्विनोन वायुमण्डलीय ऑक्सीजन द्वारा ऑक्सीकृत हो जाता है। अतः क्विनोन व हाइड्रोक्विनोन समअणुक नहीं रह पाते, जो कि उपरोक्त समीकरण प्राप्त करने की मुख्य शर्त हैं ।
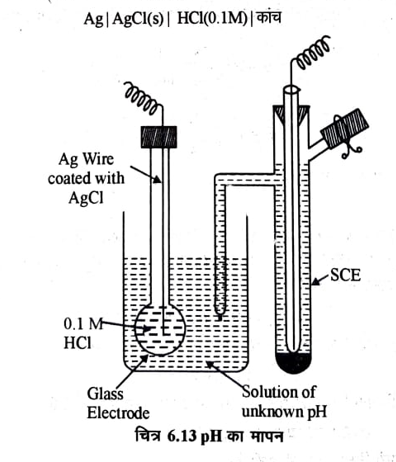
(iii) कांच इलेक्ट्रोड का उपयोग:- यह प्रयोग द्वारा स्थापित किया जा चुका है कि जब दो भिन्न-भिन्न H’ सान्द्रता या सक्रियता के विलयनों को उच्च चालकता व उच्च गलनांक के कांच की झिल्ली द्वारा पृथक किया जाता है तो कांच – विलयन अन्तरापृष्ठ (Interface) पर विभव उत्पन्न हो जाता है। यह विभव मूलतः दोनों विलयनों के हाइड्रोजन आयनों की सान्द्रता अर्थात् pH मानो के अन्तर पर निर्भर करता है। यदि एक विलयन के pH को स्थिर रखा जाये तथा दूसरे के DH को परिवर्तित किया जाये तो इलेक्ट्रोड विभव निम्न समीकरण का पालन करता है।
E°G एक स्थिरांक है तो प्रत्येक कांच के इलेक्ट्रोड का एक लाक्षणिक गुण है। यहां यह माना ग है कि इलेक्ट्रोड अभिक्रिया में H’ का अपचयन होता है।
कांच इलेक्ट्रोड एक विशेष प्रकार की कांच की नली का बना होता है जिसकी उच्च चालकता तथा उच्च गलनांक हो । एक सिरे को बल्ब का आकार दे दिया जाता है, जिसमें एक निश्चित pH का विलयन (सामान्यतया 0.1MHCI) भरा होता है। इस विलयन में रजत का एक तार डूबा रहता है। जिस पर AgCl(s) की परत जमी होती है। इस इलेक्ट्रोड का आरेख इस प्रकार लिखा जाता है-
कांच के इस इलेक्ट्रोड को SCE के साथ अज्ञात pH की गणना की जाती है। चित्र 6.13 में इस प्रकार के सेल को दिखाया गया है।
सेल का आरेख निम्न प्रकार लिखा जाता है।
E°g के मान का निर्धारण अलग से ज्ञात pH के विलयनों से बने सेल का वि.वा. बल माप कर किया जाता है। सेल का विभव मापने के लिये निर्वात नली पोटन्शियोमीटर का उपयोग किया जाता है, क्योंकि कांच के बल्ब का प्रतिरोध उच्च होता है, अतः सामान्य पोटेन्शियोमीटर का उपयोग नहीं करते।
कांच के इलेक्ट्रोड का pH मापन में व्यापक उपयोग किया जाता है क्योंकि यह इलेक्ट्रोड सरलता से ऑक्सीकारक, अपचायक, अम्लों आदि से प्रभावित नहीं होते ।
2 अभिगमनांक का निर्धारण (Determination of Transport Number):- अभिगमन युक्त सान्द्रता सेल के विभव द्वारा अपघट्य के धनायन अथवा ऋणायन के अभिगमनांक की गणना की जा सकती है।
समीकरण (40) अथवा ( 41 ) का उपयोग करके अभिगमनांक का निर्धारण किया जा सकता है।
यहां v = v+ +v_v+ तथा v क्रमशः धनायन एवं ऋणायन की संख्यायें हैं, n धनायन अथवा ऋणायन की संयोजकतायें हैं।
3 विलेयता गुणनफल का निर्धारण (Determination of Solubility product ) :- अल्पतम विलेय लवणों के विलयन में निम्नलिखित साम्य स्थापित हो जाता है। संतृप्त विलयन में ठोस लवण अपने आयनों के साथ साम्य में होता है।
BA(s) ———→ BA (विलयन) = B* + A-
इस साम्य के साम्यवस्था स्थिरांक Ksp को इस प्रकार लिखा जा सकता है-
Ksp = [B][A]]
एक ऐसे सेल का निर्माण किया जाता है, जिसमें उपरोक्त अभिक्रिया होती है।
B | BA (विलयन) BA(s) | B
इलेक्ट्रोड अभिक्रियायें निम्न प्रकार से होती है-
विद्युत रासायनिक सेलों का वर्गीकरण (Classification of Electrochemical Cells)
विद्युत रासायनिक सेलों को मुख्यतः तीन भागों में बांटा जा सकता है।
(a) प्राथमिक सेल (Primary Cells):- ये सेल अनुत्क्रमणीय (Irreversible) होते हैं। इनमें उच्च ऊर्जा रखने वाले पदार्थ शीघ्र क्रिया करके विद्युतधारा उत्पन्न करते हैं। जब तक पदार्थ रहता है, अभिक्रिया चलती रहती है और धारा उत्पन्न होती रहती है। जैसे ही पदार्थ समाप्त हो जाता है सेल निष्क्रीय हो जाता है। उदाहरण के लिये Na – Hg सेल, Zn – Hg सेल, लेक्लांची सेल (Leclanche cell) वोल्टीय सेल, शुष्क सेल (Dry Cells) आदि। इन सेलों का घडियों, टेपरीकार्डरों, कैमरों, ट्रान्जिस्टर, आदि में उपयोग किया जाता है। इन्हें पुनः सक्रिय नहीं बनाया जा सकता।
(b) द्वितीयक सेल (Secondary Cells) :- ये सेल उत्क्रमणीय (reversible) होते हैं। इनमे उच्च ऊर्जा रखने वाले पदार्थ शीघ्र क्रिया करके, धारा उत्पन्न करते हैं और अक्रिय हो जाते हैं। इन पदार्थों को बाहरी स्त्रोत से पुनः सक्रिय बना लिया जाता है। और इन्हें सेल में फिर से उपयोग किया जा सकता है यह प्रक्रम पुनः चार्ज (Recharge) कहलाता है। इस प्रकार से सेल का मुख्य उदाहरण लैड संचयी सेल (Lead storage cells), केडमीयम सेल है, जिन्हें बोलचाल की भाषा में बैटरी (Battery) कहते हैं। इसका मोटर गाडियों रेलों आदि के परिचालन में उपयोग किया जाता है।
(c) ईंधन सेल (Fuel Cells):- ईंधन सेल प्राथमिक सेलों के समान ही उच्च ऊर्जा रखने वाले पदार्थों के बने होते हैं, लेकिन ये पदार्थ ईंधन जैसे हाइड्रोजन, हाइड्रोकार्बन आदि होते हैं। ईंधन के दहन की रासायनिक अभिक्रियायें विद्युतधारा को उत्पन्न करने के लिये उत्तरदायी हैं। इन सेलों को इस प्रकार से बनाया जाता है कि इनमें ईंधन लगातार भरा जा सके और विद्युत ऊर्जा निरंतर मिलती रहे।
सेल, शक्ति का स्त्रोत (Cells, a Source of Power)
शक्ति के स्त्रोत के रूप में सेल का अर्थ है, कि सेल विभव के स्थिर रहते हुये, अधिक समय तक सेल से विद्युत ऊर्जा प्राप्त करना। इसके लिये सेल की कुछ आवश्यकतायें (Requirements) या शर्तें होती है। यदि शक्ति (Power) को P तथा विद्युतधारा को I द्वारा प्रदर्शित किया जाये तो
P =EI ……(60)
यहां E सेल विभव है। सेल से अधिक समय तक शक्ति प्राप्त करने के लिये आवश्यक है कि सेल विभव अधिक समय तक स्थिर रहे ।
समझने की दृष्टि से डेनियल सेल का उदाहरण लेते हैं, जिसका आरेख निम्न प्रकार व्यक्त कर सकते हैं-
Zn|Zn2+|| Cu2+|Cu
यहां Zn2+, Zn एक ऋणात्मक इलेक्ट्रोड (एनोड) हैअतः यह इलेक्ट्रोड बाह्य परिपथ में इलेक्ट्रोन देता है। जब इलेक्ट्रॉन बाहरी परिपथ में बहना प्रारम्भ करते हैं, और Zn, Zn 2+ में परिवर्तित होकर इलेक्ट्रॉन (Zn Zn2+ +2e) मुक्त करता है तब इलेक्ट्रोड विभव (अपचयन विभव) और कम ऋणात्मक दिशा में बढ़ता है। यदि अभिक्रिया द्वारा इलेक्ट्रॉन दिये जाने का वेग तथा बाहरी परिपथ में इलेक्ट्रॉनों के प्रवाह का वेग लगभग समान हो तो खुले परिपथ में इलेक्ट्रोड विभव व बंद परिपथ में इलेक्ट्रोड विभव लगभग समान होगें। दूसरी ओर यदि अभिक्रिया द्वारा इलेक्ट्रॉन दिये जाने का वेग कम हो तो खुले परिपथ के विभव व बंद परिपथ के विभव में अन्तर अधिक होगा और सेल विभव घट जायेगा। * इसी प्रकार यदि धंन आवेशित इलेक्ट्रोड (Cu2++2e Cu) के इलेक्ट्रॉन ग्रहण करने का वेग बाह्य परिपथ से आने वाले इलेक्ट्रॉनों के प्रवाह के वेग से कम हो तो धन इलेक्ट्रोड विभव कम हो जायेगा और इस कारण से भी सेल विभव घट जायेगा। अतः यह निश्चित है कि सेल से यदि शक्ति प्राप्त की जाती है तो सेल विभव घटता है। यदि लम्बे समय तक शक्ति प्राप्त करनी हो तो सेल अभिक्रिया होने पर सेल विभव में कमी कम होनी चाहिये। अर्थात् खुले परिपथ एवं बंद परिपथ के सेल विभव में अन्तर अधिक नहीं होना चाहिये। यह तब ही संभव है जबकि –
(i) इलेक्ट्रोड अभिक्रियायें तीव्र हों ताकि बाह्य परिपथ में इलेक्ट्रॉनों के बहने का वेग तथा इलेक्ट्रोडों द्वारा इलेक्ट्रॉन ग्रहण करने अथवा मुक्त करने का वेग लगभग समान हो। इस प्रकार विभव हास (Potential drop) कम होगा ।
(ii) इलेक्ट्रोडों की सतह (Surface) इस प्रकार की होनी चाहिये कि वे इलेक्ट्रोड अभिक्रिया के लिये उत्प्रेरक का कार्य करें।
(iii) धारा प्राप्त करने पर इलेक्ट्रोड अभिक्रिया तीव्र हों परन्तु ताप अधिक न हो ।
सेल विभव व समय के मध्य निम्न आरेख प्राप्त होता है-
जिन सेलों के लिये A प्रकार का वक्र प्राप्त होता है, उन्हें शक्ति के स्त्रोत में उपयोग में नहीं लिया जा सकता, परन्तु वे सेल जिनके लिये B प्रकार के वक्र प्राप्त होते हैं, शक्ति के स्त्रोत के रूप में उपयोगी हैं। वक्र का एक साथ झुकना इलेक्ट्रोड सक्रिय पदार्थ के समाप्त होने अथवा अक्रिय होने को दर्शाता है। ईंधन सेलों में इस समय और ईंधन भर के सेल विभव को स्थिर रखा जा सकता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics