आधुनिक आवर्त सारणी , modern periodic table in hindi , आधुनिक आवर्त सारणी की प्रवृत्ति खोज किसने की ?
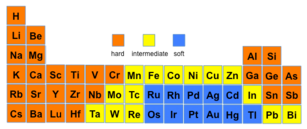
(modern periodic table in hindi ) आधुनिक आवर्त सारणी क्या है ? आधुनिक आवर्त सारणी की प्रवृत्ति खोज किसने की ? किसने बनाया बनाया या जनक कौन है ?
इस article में हम आधुनिक आवर्त सारणी (modern periodic table in hindi) के बारे में में पढेंगे |आधुनिक आवर्त सारणी में तत्वों की स्थिति
आधुनिक आवर्त सारणी में 18 खड़े स्तंभ होते हैं जिन्हें ‘समूह’ कहा जाता है तथा 7 क्षैतिज पक्तियाँ होती हैं जिन्हें ‘आवर्त’ कहा जाता है। किसी ‘समूह’ अथवा ‘आवर्त’ में तत्वों की स्थिति उन तत्वों की संयोजकता पर निर्भर करती है।
किसी भी समूह के सभी तत्वों की संयोजकता इलेक्ट्रॉनों की संख्या समान होती। एक ही समूह के सभी तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या समान है।
जैसे फ्रलुओरीन तथा क्लोरीन जो समूह-17 के तत्व हैं। फ्रलुओरीन एवं क्लोरीन के बाहरी कोश में 7 इलेक्ट्रॅान होते हैं जिसकी वजय से इसकी संयोजकता 7 होती है । किसी भी समुह के बाहरी कोश का इलेक्ट्रॉनिक विन्यास आधुनिक आवर्त सारणी में समूह को दर्शाता है। समूह में ऊपर से नीचे की ओर जाने पर कोशों की संख्या बढ़ती जाती है। परन्तु उसके बाहरी कोश में इलेक्ट्रॉन की संख्या समान रहती है।
हाइड्रोजन की स्थिति अनिश्चित रहती है क्योंकि इसे पहले आवर्त के समूह 1 या समूह 17 किसी में भी रखा जा सकता है। क्योकि दोनों ही समूह में अपना अष्टक पूर्ण करने के 1 इलेक्ट्रान की आवश्यकता होती है।
दूसरे आवर्त के तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या तो भिन्न-भिन्न होती है लेकिन इनमें कोशों की संख्या समान है। आवर्त में बाईं से दाईं ओर जाने पर यदि परमाणु-संख्या में इकाई की वृद्धि होती है तो संयोजकता इलेक्ट्रॉनों की संख्या में भी इकाई की वृद्धि होती है।
आधुनिक आवर्त सारणी की प्रवृत्ति
संयोजकता:
परमाणु साइज़ किसी परमाणु के के केंद्र से उसके सबसे बाहरी कोश की दूरी को define करता है | उदाहरनो के लिए H परमाणु के त्रिज्या 37 पीकोमीटर (पीकोमीटर, 1 pm = 10.12m) है। दूसरे आवर्त के तत्वों की परमाणु त्रिज्याएँ नीचे दी गई हैंःB : 88 pm , Be : 111 pm O : 66 pm N : 74 pm pm Li : 152 pm C: 77 pmआवत सारणी मे जब हम बाये से दाए की बढते है तब परमाणु त्रिज्या की मन घटती है क्योकि नाभिक में आवेश के बढ़ने से यह इलेक्ट्रॉनों को नाभिक की ओर खींचता है जिससे परमाणु का साइज़ घटता जाता है।
इसके अलावा जब हम आवर्त सारणी मे upper से नीचे की चलते है तब परमाणु का साइज़ बढ़ जाता है। ऐसा इसलिए होता है क्योंकि नीचे जाने पर एक नया कोश जुड़ जाता है। इससे नाभिक तथ सबसे बाहरी कोश के बीच की दूरी बढ़ जाती है और इस कारण नाभिक का आवेश बढ़ जाने के बाद भी परमाणु का साइज़ बढ़ जाता है।
जैसे की उदाहरन मे , B : 88 pm , Be : 111 pm O : 66 pm N : 74 pm pm Li : 152 pm C: 77 pm
c की परमाणु त्रिज्या 77 है और o की परमाणु त्रिज्या 66 है क्योकि c , o से पहले आता है |
और Be की परमाणु त्रिज्या 111 है और Li की परमाणु त्रिज्या 152 से क्योकि Li ,Be से निचा आता है |
धात्विक एवं अधात्विक गुणधर्म
इस पहले हम धात्विक एवं अधात्विक गुणधर्म को discuss कर चुके | इस गुणों पर परमाणु त्रिज्या का क्या प्रभाव पड़ता है | इस concept को इस article मे discuss करेगे | प्रथम समूह के तत्वों के परमाणु त्रिज्या में परिवर्तन का अध्ययन करेगे और उन्हें आरोही क्रम में व्यवस्थित किया है ।
प्रथम समूह के तत्व: Na : 186 Li : 152 Rb : 244 Cs : 262 K : 231
इन परमाणु मे से ली सबसे छोटा परमाणु है और Rb सबसा बड़ा परमाणु है | आवत सारणी मे जब हम बाये से दाए की बढते है तब परमाणु त्रिज्या की मान घटती है इसी कारन से तत्वों मे धात्विक गुणों की कमी होती है अधात्विक गुणधर्म को बढाया मिलता है | और क्योकि नाभिक में आवेश के बढ़ने से यह इलेक्ट्रॉनों को नाभिक की ओर खींचता है जिससे परमाणु का साइज़ घटता जाता है। जब हम आवत सारणी मे जब हम बाये से दाए की बढते है तब मध्य में, सिलिकन स्थित है जिसे अर्द्धधातु या उपधातु कहते हैं। यह अधातु एवं धातु दोनों के गुणधर्म होते है। आधुनिक आवर्त सारणी में एक टेढ़ी-मेढ़ी रेखा धातुओं को अधातुओं से differentiate करती है। इस रेखा पर आने वाले तत्व-बोरोन, सिलिकन, जर्मेनियम, आर्सेनिक, एेंटिमनी, टेल्यूरियम एवं पोलोनियम धातुओं एवं अधातुओं दोनों के गुणधर्म होते हैं। इसलिए इन्हें अर्द्धधातु या उपधातु भी कहते हैं।
इस आधुनिक आवर्त सारणी और तत्वों गुणों पर आधुनिक आवर्त सारणी के प्रभाव को discuss किया है |
आधुनिक आवर्त सारणी
इसमें 18 वर्ग और 7 आवर्त हैं, जिनमें से पहले, दूसरे व तीसरे आवर्त को लघु आवर्त तथा चैथे, पांचवें एवं छठे आवर्त को दीर्घ आवर्त कहा जाता है। 7वां आवर्त अधूरा है।
तत्वों को धातुओं तथा अधातुओं में बांटा जा सकता है। ज्ञात तत्वों में 75 प्रतिशत से अधिक धातुएं हैं। ये आवर्त सारणी के बाई ओर हैं। अधातुएं आवर्त सारणी के दाईं ओर उसके शीर्ष पर है।
कुछ तत्व धातुओं तथा अधातुओं दोनों के लक्षण दर्शाते हैं, इन्हें अर्ध-धातु या उपधातु कहते हैं। इनके उदाहरण हैंः जरमेनियम, सिलिकॉन, आर्सेनिक।
आवर्तों की विशेषताएं
(i) संयोजी इलेक्ट्रानः किसी आवर्त में बायें से दाये जाने पर संयोजी इलेक्ट्रॉनों की संख्या 1 से बढ़कर 8 तक हो जाती है। बाह्यतम कक्षा के इलेक्ट्रानों को संयोजी इलेक्ट्रॉन कहते हैं।
(ii) परमाणुओं का आकारः किसी आवर्त में बायें से दाये जाने पर तत्वों के परमाणुओं का आकार घटता है।
(iii) धात्विक गुणः किसी आवर्त में बायें से दायें जाने पर तत्वों का धात्विक गुण घटता है।
(iv) संयोजकताः आवर्त में बाएं से दाएं जाने पर पहले संयोजकता 1 से 4 तक बढ़ती है और फिर घटकर शून्य हो जाती है।
(1) आयनन विभवः किसी तत्व का आयनन विभव आर्वत में बायें से दायें जाने पर बढ़ता है। किसी तत्व का आयनन विभव वह न्यूनतम ऊर्जा है जो उस तत्व के एक गैसीय परमाणु की बाह्यतम कक्षा से एक इलेक्ट्रॉन को हटाने के लिए आवश्यक होती है।
(2) इलेक्ट्रॉन बंधुताः किसी आवर्त में बायें से दायें जाने पर इलेक्ट्रॉन बंधुता का मान बढ़ता है। इलेक्ट्रॉन बंधुता किसी गैसीय परमाणु के बाह्यतम कक्षा में इलेक्ट्रॉन को प्रविष्ट कराने से मुक्त होने वाली ऊर्जा है। 18वें वर्ग में यह शून्य हो जाता है।
(3) वैद्युत-ऋणात्मकताः किसी आवर्त में बाएं से दाएं जाने पर तत्व की वैद्युतऋणात्मकता बढ़ती है। किसी तत्व के परमाणु की वह क्षमता, जिसके सहारे वह साझे के इलेक्ट्रॉन जोड़ी को अपनी ओर खींचता है, उस तत्व की वैद्युत-ऋणात्मकता कहलाती है।
वर्ग आवर्त सारणी में पहले 9 वर्ग थे जिनमें से शून्य एवं 8वें वर्ग को छोड़कर सभी वर्ग दो उपवर्गों तथा में विभाजित थे। ने इन वर्गों की संख्या में उपवर्गो की संख्या को मिलाकर अब वर्गों की संख्या 18 कर दी है।
वर्ग की विशेषताएं – (i) किसी एक वर्ग के सभी तत्वों में संयोजी इलेक्ट्रॉनों की संख्या समान होती है। (ii) एक वर्ग के सभी तत्वों की संयोजिकता समान होती है। (iii) किसी वर्ग में ऊपर से नीचे आने पर परमाणु का आकार बढ़ता है। (iv) किसी वर्ग में ऊपर से नीचे आने पर तत्व के धात्विक गुण में वृद्धि होती है। (v) किसी वर्ग में ऊपर से नीचे आने पर तत्वों के आयनन विभव का मान घटता है। (vi) किसी वर्ग में ऊपर से नीचे आने पर तत्वों की इलेक्ट्रॉन बंधुता घटती जाती है। (viii) किसी वर्ग में ऊपर से नीचे आने पर वैद्युत-ऋणात्मकता घटती जाती है।
इलेक्ट्रॉन बन्धुता– उदासीन परमाणु जब एक इलेक्ट्रॉन ग्रहण करता है तो उससे जो ऊर्जा उत्पन्न होती है। उसे इलेक्ट्रॉन बन्धुता कहते हैं। अधिक इलेक्ट्रॉन बन्धुता क्लोरीन की होती है। वर्ग के तत्वों की इलेक्ट्रॉन बन्धुता उच्च होती है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics
