अभिगमनांक को प्रभावित करने वाले कारक कौन कौनसे है factors affecting transport number of ions in hindi
factors affecting transport number of ions in hindi अभिगमनांक को प्रभावित करने वाले कारक कौन कौनसे है ?
विद्युत वाहक बल विधि (EMF Method) यह विधि विशेष प्रकार के सान्द्रता सैलों (Concentration cells) के विद्युत वाहक बलों के निर्धारण पर निर्भर करती है।
अभिगमनांक को प्रभावित करने वाले कारक (Factors influencing Transport Numbers)
प्रायोगिक अध्ययन के द्वारा अभिगमनांक के निर्धारण में निम्नलिखित तथ्य सामने आये अर्थात् अभिगमनांक कुछ कारकों से प्रभावित होते हैं जो निम्नानुसार है-
(1) अभिगमनांकों के मान प्रयुक्त विद्युत वाहक बल और विद्युत धारा के सामर्थ्य पर निर्भर नहीं करते हैं।
(2) विद्युत अपघटय की सान्द्रता का प्रभाव – सान्द्रता में परिवर्तन से आयनों के अभिगमनांक बहुत कम परिवर्तिन होते.हैं। विभिन्न विद्युत अपघटयों के धनायनों के अभिगमनांकों के मान 25° से. पर भिन्न-भिन्न सान्द्रताओं के लिये सारणी 5.12 में दिये गए हैं।
सारणी 5.12
विलयनों की विभिन्न सान्द्रता पर धनायनों के 25° से पर अभिगमनांक
फिर भी ऑन्सेगर (Onsager) ने एक संबंध बताया जो इस प्रकार है।
जहाँ n तथा no आयन की विलयन में सान्द्रता C तथा अनन्त तनुता (बहिर्वेशन) पर अभिगमनांक है। यह समीकरण तनु विलयनों के लिये उपयुक्त है।
3. ताप का प्रभाप – ताप बढ़ाने पर धनायनों और ऋणायनों के अभिगमनांक बदलते है तथा प्रत्येक का मान 0.5 के लगभग हो जाता है। इसका कारण यह है कि उच्च तापों पर आयनों की समान गति करने की प्रवृति होती है।
4. विद्युत अपघट्य की प्रकृति किसी भी आयन का अभिगमनांक कोई निश्चित अंक नहीं होता बल्कि एक दूसरे आयन जो इससे सम्बन्धित होता है पर निर्भर करता है। जैसे Na+ आयन का अभिगमंनाक NaCl, NaNO3 तथा NaBr में भिन्न-भिन्न होता है। इसी प्रकार CH- आयन का अभिगमनांक NaCl में 0.604, KCI में 0.504 तथा HCI में 0.166 है। इसका कारण किसी का अभिगमनांक केवल आयन की गतिशीलता पर निर्भर नहीं करता अपितु अन्य आयनों की गतिशीलता पर भी निर्भर करता है। जिनके साथ सह संयोजित रहता है। हाइड्रोजन आयन Na’ की तुलना में अधिक गतिशील है। अतः इसका अभिगमनांक बदल गया।
5. आयनों का जलयोजन (Hydration of Ions) – कोई भी आयन जितना बड़ा होगा उतना ही कम जलयोजित होगा उतना अधिक उसका अभिगमनांक होगा।
उपरोक्त में Li छोटा होने के कारण Na+ व K+ की अपेक्षा अधिक जल योजित होगा जिससे इसका अभिगमनांक Na+ व K+ की अपेक्षा कम होगा।
6. जटिल यौगिक का बनाना (Complex formation by lons) – ( अभिगमनांकों के अपसामान्य माग)- उच्च सान्द्रता पर कुछ लवणों के आयनों के अभिगमनांकों के मान अपसामान्य आते हैं। जैसे ६ नायनो के अभिगमनांक लगभग शून्य (सारणी 5.9 में Cd2+ का) या उससे कम ऋणायन मान होते हैं। ऐसी अवस्था में ऋणायन के अभिगमनांक के मान एक से अधिक होते हैं। इसका कारण है जटिल आयन का बनना ।
जटिल आयन (Cdl4)2- तथा (Fe(CN)6 ] 4 बनने के कारण Cd2+ या Fe2+ के आयन कैथोड के बजाय ऐनोड की तरफ चलने लगते हैं क्योंकि सान्द्र विलयन में Cd2 + ऋणायन Cdl, 2- में उपस्थित रहता है इस प्रकार कैडमियम कैथोड और एनोड दोनों की ओर जाता है। जिससे उसके अभिगमनांक का ऋणात्मक मान आता है। अभिगमनाकों के इस असाधारणता के कारण इन्हें असामान्य अभिगमनांक (Abnormal transport number) कहते हैं।
चालकता मापन के अनुप्रयोग (Applications of Conductanc Measurements)
रसायन शास्त्र में चालकता के कई सीधे अनुप्रयोग हैं इनमें से कुछ निम्न है।
दुर्बल विद्युत अपघट्य की आयनन या वियोजन की मात्रा निर्धारित करना (Determination of degree of Ionisation or Dissociation of Electrolytes)
किसी विद्युत अपघट्य की V तनुता पर आयनन की मात्रा (c) निम्न प्रकार ज्ञात की जा सकती है।
“जिसमें λv = V तनुता (या सान्द्रता C) पर तुल्यांकी चालकता
λ = अनन्त तनुता (या लगभग शूल्य सान्द्रता) पर तुल्यांकी चालकता जहां कोलराऊस के नियमानुसार
मान कोलराऊस नियम के अनुसार विद्युत के आयनों की आयनिक चालकताओं को जोड़ कर प्राप्त कर सकते हैं।
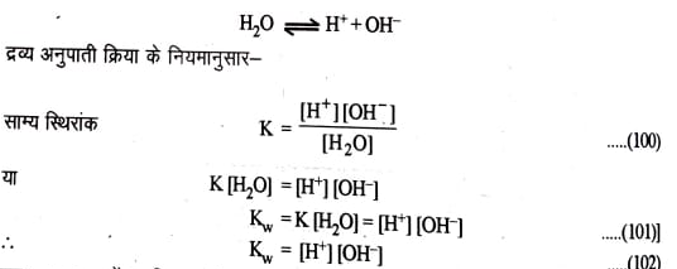
जल के आयनिक गुणनफल की गणना (Calculation of Ionic Product of Water)– शुद्ध जल एक अति दुर्बल वैद्युत अपघट्य है। इनका आयनन बहुत ही कम मात्रा में निम्न प्रकार होता है-
इस प्रकार जल में उपस्थित H’ तथा OH- आयनों के सान्द्रण का गुणनफल स्थिर ताप पर स्थिर होता है। तथा यह जल का आयनिक गुणनफल कहलाता है। इसे Kw द्वारा व्यक्त करते हैं जल के लगभग 55.4 x 107 अणुओं में से केवल एक अणु आयनित होता है। तथा आयनित जल के अणुओं की सान्द्रता स्थिर मानी जाती है।
चालकता मापन से Kw का संख्यात्मक मान निर्धारित किया जाता है या फिर कोलराऊस नियम व जल की चालकता की सहायता से जल का आयनिक गुणनफल ज्ञात किया जा सकता है।
25°C पर शुद्ध जल की विशिष्ट चालकता (k) का मान 5.54 x 10-8 ओम -1 सेमी-1 पायी गयी। चूंकि शुद्ध जल में H और OH- आयनों की सान्द्रताऐं बहुत कम है। अतः इन आयनों की चालकताओं को अनन्त तनुता पर तुल्यांकी चालकता के रूप में लिया जाता है। इस ताप पर अनन्त तनुता पर H’ और OH- आयनों की आयनिक चालकताऐं
अल्प विलेय लवणों की विलेयता का निर्धारण (Determination of solubility of sparingly soluble salts)- लवण जैसे PbSO4, BaSO4, AgCI आदि की विलेयता बहुत ही कम होती है। अतः साधारण_ रासायनिक विधियों से इन लवणों की विलेयता निर्धारित नहीं की जा सकती हैं परन्तु चालकता मापन से ऐसे लवणों की विलेयता आसानी से ज्ञात की जा सकती है। जिस लवण की विलेयता ज्ञात करनी होती है उसके ताजा अवक्षेप को धो कर चालकता मापी जल में घोला जाता है। इसे फिर हल्का गर्म करके लवण से संतृप्त कर निश्चित ताप (25°C) पर ठण्डा करते हैं। लवण की बहुत कम मात्रा जल में घुल जाएगी और शेष नीचे बैठ जाएगी। इस विलयन की चालकता माप ली जाती हैं। माना कि इस विलयन की चालकता x तथा उपयोग में लिये जल की विशिष्ट चालकता(Ks – KH2Oहै। – अतः विलेय हुये पदार्थ की चालकता KH2O) होगी। यदि पदार्थ की विलेयता C ग्रा. तुल्यांक प्रति लिटर हो तो विलयन की तुल्यांकी चालकता का मान
जल अपघटनांक (h) और जल अपघटन स्थिरांक (Kh) निर्धारित करना ( Determination of Degree of Hydrolysis and Hydrolysis Constant)– जब किसी दुर्बल अम्ल एवं प्रबल क्षार, प्रबल अम्ल एवं दुर्बल क्षार अथवा दुर्बल अम्ल एवं दुर्बल क्षार के लवण को जल में घोला जाता है तो उसका जल अपघटन होकर वही क्षार एवं अम्ल बनते है जिनका कि वह लवण बना हुआ है। उदाहरणार्थ CH3COONa जो दुर्बल अम्ल प्रबल क्षार का लवण है यह जल अपघटित होकर दुर्बल अम्ल CH3COOH तथा प्रबल क्षार NaOH देता है।
एक ग्राम अणु लवण में से जो भिन्न (अंश) जल अपघटित हो जाती है वह जल अपघटन की मात्रा या जल अपघटनांक (Degree of hydrolysis) कहलाती है। चालकता मापन से जल अपघटनांक निध् रित किया जा सकता है ।
माना कि प्रबल अम्ल और दुर्बल क्षार का एक लवण BA है जिसमें जल अपघटन के कारण निम्न साम्य स्थापित हो जाता है।
यदि लवण की जल अर्पघटन की मात्रा h हो तो, लवण के प्रत्येक ग्राम तुल्यांक के लिये साम्य पर विलयन में जल अपघटन में जल अपघटित (unhydrolysed) लवण, क्षार एवं अम्ल के ग्राम तुल्यांकों की संख्या क्रमशः (I−h), h और h होगी। चूंकि क्षार दुर्बल है अतः इसे अनायनित मान सकते हैं। अर्थात क्षार का लवण की चालकता में योगदान नहीं के बराबर है। इसलिये लवण के विलयन की चालकता बचे हुए लवण एवं बने हुए अम्ल की सान्द्रता पर निर्भर करेगी।
अम्ल की चालकता है। चूंकि अम्ल प्रबल है इसलिये यह पूर्ण आयनित होगा तथा इसकी चालकता को हम अनन्त तनुता पर तुल्यांकी चालकता मान सकते हैं। अतः कोलराऊश के नियमानुसार
दी हुई तनुता पर विलयन की तुल्यांकी चालकता (A) उसकी चालकता माप पर निर्धारित की जाती है। AMBA का मान ज्ञात करने के लिए लवण के विलयन में दुर्बल क्षार BOH बहुत मात्रा में मिलाया जाता है जिससे समीकरण (108) में साम्य बाई ओर विस्थापित हो जाता है तथा लवण के जल अपघटन का इतना शमन (suppress) हो जाता है कि मिश्रण की तुल्यांकी चालकता को जल अनअपघटित लवण की तुल्यांकी चालकता – BA के रूप में लिया जाता है। इस प्रकार h का मान निकाला जा सकता है।
मान ज्ञात होने पर जल अपघटन स्थिरांक (Hydrolysis constant) का मान निम्नलिखित सूत्र द्वारा ज्ञात किया जाता है। h
जहाँ Vएक मोल लवण रखने वाले विलयन का आयतन V लिटर में है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics