cuso4 water vapour system in hindi कॉपर सल्फेट-जल वाष्प तंत्र क्या है चित्र फार्मूला
कॉपर सल्फेट-जल वाष्प तंत्र क्या है चित्र फार्मूला cuso4 water vapour system in hindi ?
कॉपर सल्फेट-जल वाष्प तंत्र (CuSO4 Water Vapour System)
दो घटक तंत्र जिसमें ठोस व गैस दो प्रावस्था साम्य में उपस्थित रहती है। इसका उदाहरण हाइड्रेटस है। विशेष रूप से कॉपर हाइड्रेटस। इनमें दो घटक CuSO4 व जल जो आपस में क्रिया करके एक से अधिक हाइड्रेट बनाते हैं। CuSO4 H2O तंत्र में चार ठोस प्रावस्था रहती है-
है ।
(i) CuSO4.5H2O
(ii) CuSO4.3H2O
(iii) CuSO4.H2O
(iv) शुष्क CuSO4
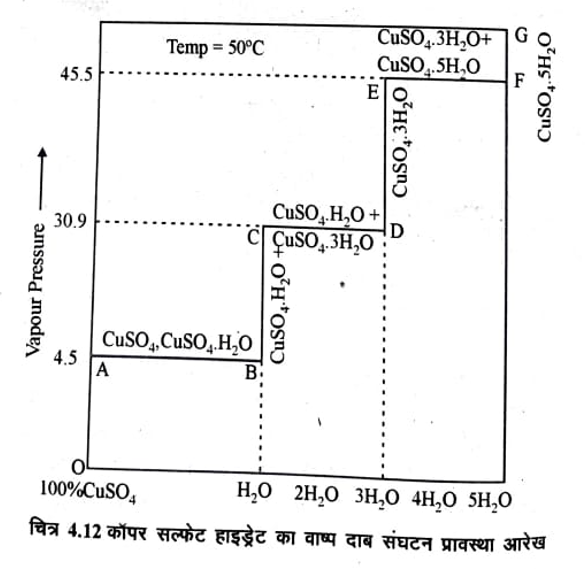
इस तंत्र का प्रावस्था आरेख निश्चित ताप 50°C वाष्प दाब व संघटन में चित्र 4. 12 में दर्शाया
बिन्दु O शुष्क CuSO4 को दर्शाता है जिसका वाष्प दाब बहुत ही कम होता है, इस निम्न दाब पर • CuSO4 व जल आपस में कोई क्रिया नहीं करते हैं अतः दो प्रावस्था उपस्थित है अतः स्वतंत्रता ही कोटि एक होगी
F = C – P + 1 = 2 – 2 +1=1
जब CuSO4 में जल वाष्प मिलाई जाती है तो वाष्प दाब OA के अनुसार बढ़ता है व लवण शुष्क रहता है लेकिन दाब 4.5 mm Hg पर या बिन्दु A पर शुष्क CuSO, जल को अवशोषित करता है व
मोनोहाइड्रेट बनाता है।
CuSO4 + H2O ⇒ CuSO4. H2O
अतः रेखा AB के सहारे तीन प्रावस्था ठोस CuSO व ठोस CuSO4. H2O व जल वाष्प साम्य में रहती है अतः तंत्र अचर (F=C-P+1=2-3+1= 0) है ।
रेखा BC पर दो प्रावस्था CuSO4. H2O व वाष्प रहती है अतः यह एक चर (F= C-P+1= 2-2+1=1) है।
इसमें और अधिक जल वाष्प मिलाने पर वाष्प दाब 30.9 mm Hg तक बढ़ता है तथा इस दाब या बिन्दु C पर CuSO4. H2O, CuSO4. 3H2O में बदलना प्रारम्भ होता है।
CuSO4. H2O + H2O ===== CuSO4. 3H5O
इसकों CD द्वारा प्रदर्शित करते हैं। यहाँ तीन प्रावस्था उपस्थित है अतः यह तंत्र भी अचर है अर्थात् वाष्प दाब स्थिर रहता है जब तक कि सारा CuSO4. H2O पूरे CuSO4. 3H2O में नही बदल जाता है इसके बाद जल वाष्प मिलाने पर दाब और बढ़ता है। बिन्दु E वाष्प दाब 45.5 mm Hg पर जल वाष्प ग्रहण करके CuSO4. 3H2O, CuSO4. 5H2O पेन्टा हाइड्रेट में बदलता हैं इसकों से प्रदर्शित करते है इस पर तीन प्रावस्था ठोस CuSO4. 3H2O ठोस CuSO4. 5H2O व जल वाष्प साम्य में है अतः तंत्र अचर है।
बिन्दु F पर CuSO4 का हाइड्रेट में बदलना पूरा हो जाता है व यहाँ ठोस CuSO, SHO जल वाष्प के साम्य में रहता है अतः रेखा FG एक चर है।
द्रव द्रव मिश्रण (Liquid – Liquid Mixtures)
एक द्रव को जब किसी दूसरे द्रव में मिलाया जाता है तो तीन प्रकार की स्थितियाँ बन जाती हैं-
(i) एक द्रव दूसरे द्रव में प्रत्येक अनुपात में मिश्रित हो जाये। उदाहरण के लिये जल – एल्कोहॉल का मिश्रण एल्कोहॉल जल में अथवा जल एल्कोहॉल में प्रत्येक अनुपात में मिश्रणीय होता है। इन द्रवों को पूर्णतया मिश्रणीय द्रव (Completely miscible liquids) कहते हैं।
(ii) एक द्रव दूसरे द्रव में बिल्कुल की मिश्रित न हो। एक दूसरे को मिलाने पर दो पृथक परतों के रूप में अलग-अलग हो जाये। उदाहरण के लिये जल – नाइट्रोबेंजीन अथवा जल- कार्बन टेट्राक्लोराइड का मिश्रण इन द्रवों को अमिश्रणीय द्रव (immiscible liquids) कहते हैं।
(ii) कुछ ऐसे द्रव होते हैं जो एक दूसरे में एक निश्चित सीमा तब ही विलेय होते हैं। ये द्रव आंशिक रूप से मिश्रणीय द्रव (partially miscible liquids) कहलाते हैं। फीनोल-जल, ऐनिलीन – जल आदि इस प्रकार के मिश्रण के उदाहरण हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics