raoult’s law in hindi definition राउल्ट का नियम क्या है सूत्र किसे कहते हैं लिखिए
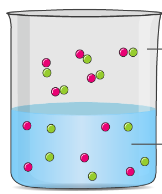
आदर्श विलयन (Ideal Solution)
आदर्श विलयन की धारणा विलयन के ऊष्मागतिक गुणों के समझने के लिये आवश्यक होती है। आदर्श विलयन उस विलयन को कहा जाता है। जिसमें संसंजक बल (Cohesive forces) पूर्णरूप से समान (uniform) हों। अर्थात विलेय-विलेय, विलेय-विलायक तथा विलायक विलायक अणुओं के मध्य अन्तर आण्विक आकर्षण बल पूर्णतया समान हों।
आदर्श विलयनों के लक्षण (characteristics of ideal solutions) – एक आदर्श विलयन में निम्नलिखित लक्षण होना आवश्यक है।
(i) विलेय एवं विलायक को मिलाने पर ऊष्मा परिवर्तन शून्य हो। अर्थात् AH (मिश्रण) = 0
(ii) विलयन का कुल आयतन विलेय तथा विलायक के आयतन के योग के बराबर हो अर्थात् आयतन परिवर्तन शून्य हो। H (मिश्रण) = (0
(iii) विलयन सान्द्रता की प्रत्येक सीमा में राऊल के नियम (Raoult’s law) का पालन करें।
राऊल का नियम (Raoult’s Law)
द्रवों के अणुओं की द्रव अवस्था से गैसीय अवस्था में पलायन करने की प्रकृति ( escaping tendency) होती है। इसी प्रकृति के कारण द्रवों में वाष्प दाब उत्पन्न होता है। वाष्प दाब का पिछले अध्याय में विवेचन किया गया है।
द्रवों के विलयन में यदि दोनों द्रव वाष्पशील होते हैं तो दोनों ही द्रवों के अणुओं की पलायन की प्रकृति होती है। एक आदर्श विलयन में प्रत्येक अवयव का अपना एक निश्चित वाष्प दाब होता है सम्पूर्ण विलयन का वाष्प दाब, प्रत्येक अवयव के वाष्प दाब के योग के बराबर ( डाल्टन का आंशिक दाब का नियम) होता है।
यदि PA तथा PB द्रव A तथा B के आंशिक दाब हों तो कुल दाब (P) का मान (PA + PB) होता है। राऊल के नियम की सहायता से प्रत्येक अवयव का आंशिक दाब (अर्थात् P तथा PD) का मान ज्ञात किया जा सकता है।
राऊल के नियम के अनुसार “एक निश्चित ताप पर किसी विलयन के वाष्पशील अवयव का वाष्पदाब, उस अवयव की विलयन में मोल भिन्न तथा शुद्ध अवयव के वाष्प दाब के गुणनफल के बराबर होता है।”
माना कि A तथा B दो वाष्पशील पूर्णतया मिश्रणीय द्रव हैं, शुद्ध द्रवों के वाष्प दाब क्रमश: P P‡B हैं इन द्रवों से बने आदर्श विलयन में इनकी मोल भिन्न क्रमशः X तथा XB है। यदि P तथा PB विलयन में A तथा B के आंशिक दाब हों तो राऊल के नियम के अनुसार-
समीकरण (3). (4) तथा (5) सरल रेखा को प्रदर्शित करती है। यदि वाष्प दाब तथा मोल भिन्न में आरेख खींचा जाता है तो चित्र (4.13) में दिखाये अनुसार सरल रेखाएँ प्राप्त होती है। चित्र 4.13 में बिन्दुकित रेखाएँ समीकरण (3) तथा (4) से प्राप्त रेखाएँ है। जो कि A तथा B के आंशिक टाब प्रदर्शित करते हैं जब XB = 1 है तो वह शुद्ध B को प्रदर्शित करता है, इस स्थिति में PB=P°B| इसी प्रकार जब X = 1 है तो शुद्ध A को प्रदर्शित करता है और इस स्थिति में PA = P°A | सतत रेखा विलयन का कुल वाष्पदाब बताती है। यह रेखा समीकरण (7) द्वारा प्राप्त होती है। प्रत्येक सान्द्रता के विलयन का इस रेखा पर कुल वाष्प दाब दोनों अवयवों के आंशिक दाब के योग के बराबर होगा।
आदर्श विलयनों के कुछ उदाहरण-
(1) n हैसेन एवं n हेप्टेन –
(2) एथिल ब्रोमाइड एवं एथिल आयोडाइड
(3) बेंजीन एवं टॉलुईन
(4) क्लोरोबेंजीन एवं ब्रोमोबेंजीन
(5) बेंजीन एवं एथीलीन क्लोराइड
(6) एथीलीन डाइब्रोमाइड एवं प्रोपिलीन डाईब्रोमाइड, PB
आदर्श विलयनों में वाष्पदाब एवं वाष्प संघटन
(Vapour Pressure and Vapour Composition in Ideal Solutions) समीकरण (7) विलयन के कुल वाष्प दाब एवं विलयन में प्रत्येक अवयव के संघटन (मोल मिन्न) में संबंध है । विलयन के ऊपर उपस्थित वाष्प प्रावस्था में भी अवयवों का संघटन ज्ञात किया जाता है। माना कि अवयव B की वाष्प प्रावस्था में मोल भिन्न Y, तथा विलयन में मोल भिन्न X है।
(चूंकि आंशिक दाब = मोल भिन्न x कुल दाब)
यहाँ P विलयन का कुल वाष्प दाब तथा PB अवयव B का आंशिक वाष्प दाब है ।
उपर्युक्त समीकरण में P° तथा Pg शुद्ध A तथा B के वाष्प दाब है जो कि निश्चित ताप पर स्थिरांक है यदि विलयन में प्रत्येक अवयव की मोल भिन्न ज्ञात हो तो YB का मान ज्ञात किया जा सकता है। यदिY वाष्प प्रावस्था में अवयव A की मोल भिन्न हो
समीकरण (12) तथा (13) कुल वाष्प दाब P तथा वाष्प प्रावस्था में संघटन में संबंध प्रदर्शित करती है। यह संबंध एक सरल रेखा को प्रदर्शित नहीं करता ।
समीकरण (10) द्वारा वाष्प दाब – संघटन आरेख प्राप्त किया जा सकता हैं कुछ दाब P को XB तथा YB के साथ आलेखित करने पर चित्र (4.14) के अनुसार वक्र प्राप्त होते हैं। चित्र में यह देखा गया है कि वाष्प संघटन वक्र विलयन वक्र से हमेशा नीचे होता है क्योंकि एक निश्चित ताप पर द्रव उच्च दाब पर तथा गैस निम्न दाब पर स्थायी होती है। द्रव संघटन रेखा के ऊपर किसी बिन्दु पर केवल द्रव जबकि वाष्प संघटन वक्र के नीचे केवल वाष्प होती है इन दोनों के मध्य किसी बिन्दु पर द्रव और वाष्प दोनों साम्यवस्था में होती है ।
माना कि बिन्दु a दोनों केन्द्रों के मध्य है। यहाँ दोनों प्रावस्था स्थित हैं। इन दोनों प्रावस्थाओं को संघटन a से गुजरने वाली क्षैतिज रेखा bc द्वारा ज्ञात किया जा सकता है जो कि क्रमशः द्रव संघटन रेखा को b पर तथा वाष्पदाब संघटन रेखा को c पर काटती है। b तथा c के संघटन क्रमशः X1 तथा X2 ही द्रव प्रावस्था तथा वाष्प प्रावस्था के संघटन है। रेखा bc को टाई रेखा (tie line) कहते हैं ।
वाष्प प्रावस्था तथा विलयन में किसी अवयव की मोल भिन्न का अनुपात (Ratio of mole fraction of a constituent in vapour phase and solution)
मान लीजिये कि विलयन के अवयव B की वाष्प प्रावस्था तथा विलयन में मोल भिन्नों का अनुपात करना है अर्थात् YB/XB ज्ञात करना है।
समीकरण (8) के अनुसार
समीकरण (14) से स्पष्ट है कि PB> P°A अर्थात् B द्रव A की तुलना में अधिक वाष्पशील है तथा YB/XB का अनुपात 1 से अधिक होगा। अतः यह कहा जा सकता हैं कि अधिक वाष्पशील अवयव की विलयन की तुलना में वाष्प में अधिक प्रतिशतता होती है।
राऊल के नियम से विचलन (अनादर्श विलयन) (Deviation from Raoult’s law (Non-ideal solution))
जैसा कि पूर्व में बताया जा चुका है कि आदर्श विलयनों में संसजक बल पूर्णतया समान होते हैं। यदि विलेय-विलायक अणुओं के मध्य आण्विक आकर्षण बल विलेय-विलेय तथा विलायक – विलायक अणुओं के मध्य के अन्तरा आण्विक आकर्षण बल से भिन्न हों तो विलयन अनादर्श विलयन कहलाता है और वह राऊल के नियम से विचलन (deviation) दर्शाता है।
माना कि विलयन A तथा B अवयवों से बना है। यदि A- A तथा B-B में अन्तरा आण्विक आकर्षण बलों से A-B के अन्तरा आण्विक बल भिन्न है तो विलयन अनादर्श विलयन कहलाता है। राऊल के नियम से विचलन दो प्रकार के हो सकते हैं।
राऊल के नियम से धनात्मक विचलन (Positive deviation from Raoult’s law)
वे विलयन जिनमें अवयव को वाष्प दाब, उस अवयव के राऊल के नियम द्वारा दर्शाये गये वाष्पदाब से अधिक प्राप्त हो धनात्मक विचलन दर्शाते हैं।-
अर्थात्
PA>P°AXA_तथा_PB>PBXB
धनात्मक विचलन दाब तब संभव होता है जब विलेय-विलायक अणुओं के मध्य अंतरा आण्विक बल विलेय-विलेय अथवा विलायक – विलायक अणुओं के मध्य अन्तरा आण्विक आकर्षण बल से कम हों। अर्थात् A B के मध्य आकर्षण बल A- A अथवा B-B के मध्य आकर्षण बलों से कम हो। इसका परिणाम यह होता है कि विलयन में A तथा B की पलायन प्रकृति शुद्ध A तथा शुद्ध B की तुलना में अधिक होती है। अतः विलयन का वाष्प दाब अधिक हो जाता है।
चित्र 4.15 में एथेनॉल – जल अनादर्श विलयन के वाष्प दाब वक्र को दर्शाया गया है।
चित्र में बिन्दुकित रेखाऐं आदर्श व्यवहार (Ideal behaviour) को दर्शाती है, जबकि सतत रेखाएँ अनादर्श व्यवहार को प्रदर्शित करती हैं
धनात्मक विचलन दर्शाने वाले विलयनों में विलयन बनने पर ऊष्मा अवशोषित होती है। अतः H (मिश्रण) का मान धनात्मक होता है।
अर्थात
H (मिश्रण) > 0
इसी प्रकार धनात्मक विचलन दर्शाने वाले विलयन का आयतन विलेय और विलायक के आयतन, के योग से अधिक होता हैं अतः V (मिश्रण) का मान धनात्मक होता है।
अर्थात V(मिश्रण) > 0
राऊल के नियम से ऋणात्मक विचलन (Negative deviation from Raoult’s law) वे विलयन जिनमें अवयव का वाष्प दाब, उस अवयव के राऊल के नियम द्वारा दर्शाये गये वाष्प दाब से कम हो, ऋणात्मक विचलन दर्शाते हैं।
अर्थात्
PA<P°AXA तथा PB < PBXB
ऋणात्मक विचलन तब संभव होता है जबकि विलेय-विलायक अणुओं के मध्य अंतरा आण्विक आकर्षण बल विलेय- विलेय अथवा विलायक – विलायक अणुओं के मध्य अन्तरा आण्विक आकर्षण बल से अधिक हो। अर्थात् A-B के मध्य आकर्षण बल A-A अथवा B-B के मध्य आकर्षण बलों से अधिक हो । इसका परिणाम यह होता है कि विलयन में A तथा B की पलायन प्रकृति शुद्ध A तथा शुद्ध B की पलायन प्रकृति की तुलना में कम होती है. अतः विलयन का वाष्प दाब कम हो जाता है।
चित्र में 4.16 एक ऋणात्मक विचलन वाले अनादर्श विलयन के वाष्प दाब वक्र को दर्शाया गया
चित्र में बिन्दुकित रेखाऐं आदर्श व्यवहार को दर्शाती है, जबकि सतत रेखाएँ अनादर्श व्यवहार को प्रदर्शित करती हैं
ऋणात्मक विचलन दर्शाने वाले विलयन बनने पर ऊष्मा उत्सर्जित होती है अतः H (मिश्रण) का मान ऋणात्मक होता है।
अर्थात H (मिश्रण) <0
इसी प्रकार ऋणात्मक विचलन दर्शाने वाले विलयन का आयतन विलेय और विलायक के आयतन के योग से कम होता हैं अतः V (मिश्रण) का मान ऋणात्मक होता है।
अर्थात V (मिश्रण) <0
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics