सहसंयोजक बंध सिद्धांत या संयोजकता बंध सिद्धांत , सिग्मा (σ) और पाई (π) बन्धो में अंतर , अनुनाद प्रभाव
सिग्मा (σ) और पाई (π) बन्धो में अंतर
|
सिग्मा (σ) बंध
|
पाइ (π) बन्ध
|
|
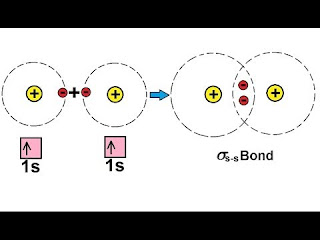
1. s-s , s-p और p-p कक्षकों के समाक्ष (अक्षीय) अतिव्यापन से हमेशा सिग्मा (σ) बंध बनता है।
|
p-p कक्षकों के समपाशर्विक अतिव्यापन से हमेशा पाइ (π) बंध का निर्माण होता है।
|
|
2. σ कक्षकों के मध्य अतिव्यापन अधिक होता है अत: यह बंध प्रबल होता है।
|
π कक्षकों के मध्य अतिव्यापन कम होता है अत: ये बंध दुर्बल होते है।
|
|
3. σ बन्धो को तोड़ने के लिए अधिक ऊर्जा की आवश्यकता होती है।
|
π बन्धो को तोड़ने के लिए कम ऊर्जा की आवश्यकता होती है।
|
|
4. यह बंध अकेला अर्थात π बंध की अनुपस्थिति में भी बन सकता है।
|
यह बंध हमेशा σ (सिग्मा) बंध की उपस्थिति या बाद में बनता है।
|
|
5. σ बंध के चारो ओर परमाणुओं का मुक्त घूर्णन संभव है।
|
π बंध के चारो ओर परमाणुओं का मुक्त घूर्णन संभव nhi है। |
|
6. σ (सिग्मा) बन्ध में कोई नोडीय तल नहीं पाया जाता है।
|
π बंध में नोडीय तल पाया जाता है।
|
अनुनाद प्रभाव
अनुनादी ऊर्जा
औपचारिक आवेश
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics