द्विध्रुव आघूर्ण : dipole moment in hindi , द्विध्रुव आघूर्ण की परिभाषा क्या है , मात्रक , सूत्र , द्विध्रुव शून्य होता है।
द्विध्रुव आघूर्ण : किसी ध्रुवीय अणु में किसी एक परमाणु पर उपस्थित आवेश की मात्रा (q या e) तथा दोनों परमाणुओं के नाभिकों के मध्य की दूरी (d या r) के गुणनफल को द्विध्रुव आघूर्ण कहते है।
, Cl2 , O2 , N2 आदि।
2. दो परमाणुओं की विद्युत ऋणात्मकता में जितना ज्यादा अंतर होता है द्विध्रुव आघूर्ण का मान उतना ही अधिक होता है।
उदाहरण : H-X का द्विध्रुव आघूर्ण निम्न क्रम में घटता जाता है –
जहाँ -X = -F , -Cl , -Br , -I
H-F > H-Cl > H-Br > H-I
3. किसी बहुपरमाण्वीय अणु का द्विध्रुव आघूर्ण उसमें उपस्थित सभी ध्रुवीय बन्धो के द्विध्रुव आघूर्ण के सदिश योग के बराबर होता है।
4. वे अणु जिनकी संरचना रेखीय , समतल , त्रिकोणीय तथा चतुष्फलकीय होती है एवं केन्द्रीय परमाणु से जुड़े सभी परमाणु समान होते है तो उनका द्विध्रुव आघूर्ण शून्य होता है तथा ऐसे अणु अध्रुवीय अणु कहलाते है।
उदाहरण : CO2 , BeCl2 आदि।
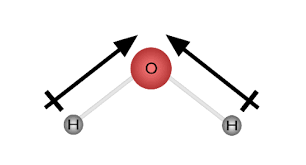
5. वे अणु जिनकी संरचना कोणीय होती है उनका द्विध्रुव आघूर्ण निश्चित होता है तथा ऐसे अणु ध्रुवीय अणु कहलाते है।
NH2 = μ = 1.85 D
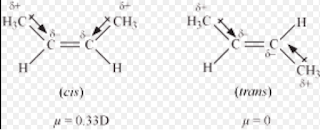
6. समपक्ष यौगिक का द्विध्रुव आघूर्ण विपक्ष यौगिक से अधिक होता है।
प्रश्न 1 : NH3 का द्विध्रुव आघूर्ण NF3 से अधिक होता है , क्यों ?
उत्तर : NH3 में N2 की विद्युत ऋणता H2 से अधिक होती है इसमें तीन N-H बंध व एकाकी इलेक्ट्रॉन युग्म का द्विध्रुव आघूर्ण एक ही दिशा में होने के कारण परिणामी द्विध्रुव आघूर्ण का मान अधिक होती है।
NF3 में F की विद्युत ऋणता N2 से अधिक होती है , इसमें तीन N-F बंध का द्विध्रुव आघूर्ण तथा एकांकी इलेक्ट्रॉन युग्म का द्विध्रुव आघूर्ण एक दुसरे के विपरीत होता है अत: परिणामी द्विध्रुव आघूर्ण का मान कुछ कम हो जाता है।