उपसहसंयोजक यौगिको में आबन्धन , VBT – valence bond theory (संयोजकता बंध सिद्धांत) , VBT – valence bond theory (संयोजकता बंध सिद्धांत)
1. VBT – valence bond theory (संयोजकता बंध सिद्धांत)
2. CFT – crystal field theory (क्रिस्टल क्षेत्र सिद्धांत)
3. LFT – legend field theory
4. MOT – molecular orbital theory
1. VBT – valence bond theory (संयोजकता बंध सिद्धांत)
इस सिद्धांत के मुख्य बिंदु निम्न है –
- सर्वप्रथम केन्द्रीय धातु परमाणु अपनी ऑक्सीकरण अवस्था के अनुरूप इलेक्ट्रॉन त्याग कर धनायन बनाता है।
- इस धातु धनायन के पास लिगेंड को जोड़ने के लिए रिक्त s,p,d कक्षक उपलब्ध होते है।
- यह रिक्त कक्षक आपस में मिलकर संकरित कक्षकों का निर्माण करते है।
- इन रिक्त संकरित कक्षको में लिगेंड अपना एकांकी इलेक्ट्रोन युग्म प्रदान करके धातु आयन के साथ बंध बना लेता है।
- इसी संकरण के आधार पर संकुल यौगिक की ज्यामिति निर्धारित होती है –
|
संकरण
|
ज्यामिति
|
|
SP3
|
चतुष्फलकीय
|
|
dsp2
|
वर्ग समतलीय
|
|
d2sp3
|
अष्टफलकीय (बाह्य
कक्षक संकुल) |
|
Sp3d2
|
अष्टफलकीय (आन्तरिक
कक्षक संकुल) |
- यदि संकरण में आन्तरिक d कक्षक भाग लेते है तो आंतरिक कक्षक संकुल बनता है लेकिन यदि संकरण में बाह्य d कक्षक भाग ले तो बाह्य कक्षक संकुल बनता है। आंतरिक कक्षक संकुल / चक्रण युग्मित संकुल / निम्न चक्रण संकुल।
- बाह्य कक्षक संकुल / चक्रण मुक्त संकुल / उच्च चक्रण संकुल।
- यदि धातु आयन के असंकरित कक्षकों में सभी इलेक्ट्रोन युग्मित हो तो वह यौगिक प्रतिचुम्बकीय होगा , लेकिन यदि अयुग्मित इलेक्ट्रोन उपस्थित हो तो वह यौगिक अनुचुम्बकीय होगा।
- यौगिक के चुम्बकीय आघूर्ण के मान को निम्न सूत्र द्वारा ज्ञात कर सकते है –
- यदि अयुग्मित इलेक्ट्रोन उपस्थित हो तो वह यौगिक रंगीन होगा तथा यदि अयुग्मित इलेक्ट्रोन अनुपस्थित हो तो वह यौगिक रंगहीन होगा।
2. CFT – crystal field theory (क्रिस्टल क्षेत्र सिद्धान्त)
- यह सिद्धांत सर्वप्रथम आयनिक क्रिस्टलो पर लागू किया गया इसलिए इसे क्रिस्टल क्षेत्र सिद्धांत कहते है।
- इस सिद्धांत के अनुसार केंद्रीय धातु आयन व लिगेंड आपस में स्थिर विद्युत आकर्षण बल या आयनिक बंध द्वारा बंधित होते है।
- यह स्थिर विद्युत आकर्षण बल , केन्द्रीय धातु आयन के धनावेश व लिगेंड के ऋण आवेश के कारण उत्पन्न होता है।
- यदि लिगेंड उदासीन हो तो वह द्विध्रुव की तरह व्यवहार करता है तथा उस लिगेंड का ऋण आवेशित सिरा धातु आयन की ओर विन्यासित होता है।
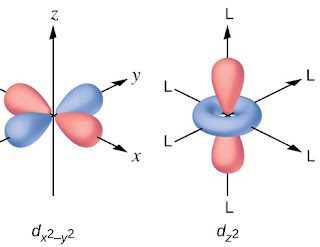
- केन्द्रीय धातु आयन के पास उपस्थित पाँचो d कक्षको की ऊर्जा एक समान होती है इसलिए इन्हें समभ्रंश d कक्षक कहते है।
- इस सिद्धान्त के अनुसार जब लिगेंड धातु आयन से जुड़ने के लिए धातु आयन की ओर अग्रसर होते है तो यह धातु आयन के d कक्षकों की ऊर्जा को प्रभावित करते है जिससे धातु आयन के यह d कक्षक दो भागो में बंट जाते है – (i) t2g कक्षक (ii) eg कक्षक
- यह घटना क्रिस्टल फिल्ड विपाटन कहलाती है तथा इन t2g व eg कक्षकों के मध्य ऊर्जा के अन्तर को क्रिस्टल फिल्ड विपाटन ऊर्जा कहते है।
अष्टफलकीय संकुलों में क्रिस्टल फिल्ड विपाटन
स्पेक्ट्रो रासायनिक श्रेणी
चतुष्फलकीय संकुलों में क्रिस्टल फिल्ड विपाटन
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics