समावयता : उपसहसयोजक यौगिको में समावयता (isomerism in coordination compounds) , प्रकार
समावयता : दो या दो से अधिक ऐसे यौगिक जिनके अणुसूत्र समान हो लेकिन संरचना सूत्र या त्रिविमीय विन्यास में भिन्नता के कारण उनके गुण भिन्न भिन्न हो तो वे यौगिक एक दुसरे के समावयवी कहलाते है तथा उनका यह गुण समावयता कहलाता है।
समावयाता के प्रकार :
यह दो प्रकार की होती है –
1. संरचनात्मक समावयता
2. त्रिविमिय समावयता
संरचनात्मक समावयता भी छ: प्रकार की होती है –
(i) आयनन समावयता
(ii) बंधक / बंधनी समावयता
(iii) उपसहसयोजक समावयता
(iv) हाइड्रेट / विलायक योजन समावयता
(v) लिगेंड समावयता
(vi) उपसहसयोजक स्थिति समावयता
त्रिविमिय समावयता दो प्रकार की होती है –
(i) ज्यामितीय समावयता
(ii) प्रकाशिक या ध्रुवण समावयता
1. संरचनात्मक समावयता
(i) आयनन समावयता : दो या दो से अधिक ऐसे यौगिक जिनके अणु सूत्र समान हो लेकिन जलीय विलयन में वे भिन्न भिन्न प्रकार से आयनित होते हो तो वे यौगिक एक दुसरे के आयनन समावयवी कहलाते है।
उदाहरण : CO(NH3)5SO4Br के दो आयनन समावयवी है।
(a) [CO(NH3)5SO4]Br ⇌ [CO(NH3)5SO4]+ + Br– में AgNO3 के साथ AgBr का अवक्षेप देता है लेकिन दूसरा यौगिक में अवक्षेप नहीं होगा।
(b) [CO(NH3)5Br]SO4 ⇌ [CO(NH3)5Br]2+ + SO42- में BaCl2 के साथ BaSO4 का श्वेत अवक्षेप देता है लेकिन दूसरा यौगिक अवक्षेप नहीं देता है।
(ii) बंधक / बंधनी समावयता : दो या दो से अधिक ऐसे यौगिक जिनके अणुसूत्र समान हो लेकिन उनमे उपस्थित उभयदन्तुक लिगेंड भिन्न भिन्न दाता परमाणु द्वारा केन्द्रीय धातु आयन के साथ जुड़ा हो तो ऐसे यौगिक एक दुसरे के बंधनी समावयवी कहलाते है।
[Cr(H2O)5(CN)]Br2 व [Cr(H2O)5(NC)]Br2
(iii) उपसहसयोजक समावयता या समन्वय समावयता : इस प्रकार की समावयता उन यौगिको में पायी जाती है जिनमे धनायन व ऋण आयन दोनों ही संकुल के रूप में उपस्थित हो। यह समावयता संकुल धनायन व संकुल ऋणायन में लिगेंडो के परस्पर विनिमय से उत्पन्न होती है।
[CO(NH3)6][Cr(CN)6] व [Cr(NH3)6][CO(CN)6]
(iv) हाइड्रेट / विलायकयोजन समावयता : दो या दो से अधिक ऐसे यौगिक जिनके अणुसूत्र समान हो लेकिन उनमे जल के अणुओं की संख्या समन्वय मण्डल व आयनिक मंडल में भिन्न भिन्न हो तो वे यौगिक एक दुसरे के हाइड्रेट समावयवी कहलाते है।
उदाहरण : [Cr(H2O)6]Cl3 बैंगनी हरा
[Cr(H2O)4Cl2]Cl.(H2O)2 गहरा हरा रंग
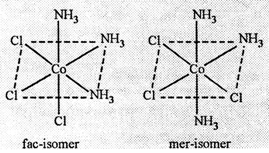
2. त्रिविमीय समावयता
3. [M(AA)2X2] प्रकार
(ii) प्रकाशिक या ध्रुवण समावयता (optical isomers)
समन्वय संख्या चार वाले यौगिको में चतुष्फलकीय संकुल व समन्वय संख्या छ: वाले यौगिको में अष्टफलकीय संकुल प्रकाशिक समावयता दर्शाते है।
चतुष्फलकीय संकुल : इसमें प्रकाशिक समावयता दर्शाने वाले यौगिक के निम्न प्रकार है –
1. [M(AB)2] प्रकार : यह (AB) असममित द्विदन्तुक लिगेंड है।
अष्टफलकीय संकुल : इसमें प्रकाशिक समावयता दर्शाने वाले यौगिक निम्न है –
[M(A-A)X2Y2] प्रकार
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics