निक्षालन विधि / रासायनिक विधि : बेयर विधि , हॉल , सरपेक विधि , भर्जन (Roosting) , निस्तापन (calcination)
इस विधि में अशुद्ध धातु अयस्क को किसी उपयुक्त विलायक में घोलकर रासायनिक अभिक्रियाओं द्वारा धातु का सांद्रित अयस्क प्राप्त किया जाता है।
जैसे :
(a) बॉक्साइट से एलुमिना का निक्षालन : बॉक्साइट (Al2O3.2H2O) उभयधर्मी प्रकृति का होता है। इस अयस्क Fe2O3 , SiO2 व सूक्ष्म मात्रा में TiO2 की अशुद्धियां उपस्थित होती है , इन अशुद्धियो की मात्रा के आधार पर निक्षालन के लिए तीन विधियाँ काम में ली जाती है।
(i) बेयर विधि
(ii) हॉल विधि
(iii) सरपेक विधि
(i) बेयर विधि : यह विधि तब काम ली जाती है जब बॉक्साइड अयस्क में Fe2O3
व SiO2 की अशुद्धियाँ बराबर मात्रा में हो। इस विधि में होने वाली रासायनिक अभिक्रिया निम्न प्रकार है –
Al2O3.2H2O + 2NaOH → 2H2O + 2NaAlO2
इस सोडियम मेटा एलुमिनेट से शुद्ध एलुमिना प्राप्त करने की दो विधियाँ है –
पहली विधि :
2Al(OH)2 → Al2O3 + 3H2O
दूसरी विधि :
Al2O3.H2O → Al2O3 + H2O
(ii) हॉल विधि : यह विधि तब काम में ली जाती है जब बॉक्साइड अयस्क में Fe2O3 की अशुद्धियाँ अधिक मात्रा में उपस्थित हो।
इस विधि में होने वाले रासायनिक अभिक्रिया निम्न प्रकार है –
2Al(OH)3 → Al2O3 + 3H2O
(iii) सरपेक विधि : यह विधि तब काम में ली जाती है जब बॉक्साइड अयस्क में SiO2 की अशुद्धियाँ अधिक मात्रा में उपस्थित होती हो।
इस विधि में होने वाली रासायनिक अभिक्रिया निम्न प्रकार है –
2Al(OH)3 → Al2O3 + 3H2O
(b) Ag व Au के अयस्को का निक्षालन / साइनाइड प्रक्रम
Ag व Au धातु अयस्को के निक्षालन के लिए इन अशुद्ध धातु अयस्कों की क्रिया किसी उपयुक्त विलायक जैसे – NaCN से करवाकर इन धातुओं को विलेयशील संकुल के रूप में प्राप्त करते है। अब में उपस्थित धातु को किसी अधिक क्रियाशील धातु जैसे – जिंक से प्रतिस्थापित करवाकर इन धातुओं का सांद्रित अयस्क प्राप्त कर लेते है। इस प्रक्रिया को जल धातु क्रम भी कहते है।
(i) Ag अयस्क का निक्षालन : Ag का निक्षालन Ag के अशुद्ध अयस्क AgCl (हॉर्न सिल्वर) व Ag2S (सिल्वर ग्लान्स) से किया जाता है।
इसकी रासायनिक अभिक्रिया निम्न प्रकार है –
(ii) Au अयस्क का निक्षालन : इसकी रासायनिक अभिक्रिया निम्न प्रकार है –
2Na[Au(CN)2] + Zn → Na2[Zn(CN)4] + 2Au
Au व Ag के निक्षालन की आयनिक अभिक्रियाएँ निम्न प्रकार है –
(a) Ag के निक्षालन की आयनिक अभिक्रिया –
2[Ag(CN)2]– + Zn → [Zn(CN)4] + 2Ag
(b) Au के निक्षालन की आयनिक अभिक्रिया –
2[Au(CN)2]– + Zn → [Zn(CN)2] + 2Au
प्रश्न : निष्कर्षण किसे कहते है ?
उत्तर : सांद्रित अयस्क से मुक्त अवस्था में अशोधित धातु प्राप्त करने की प्रक्रिया निष्कर्षण कहलाती है . यह प्रक्रिया दो चरणों में संपन्न होती है .
I. सान्द्रित अयस्क का धातु ऑक्साइड में परिवर्तन।
II. धातु ऑक्साइड का अपचयन
3. सान्द्रित अयस्क का धातु ऑक्साइड में परिवर्तन
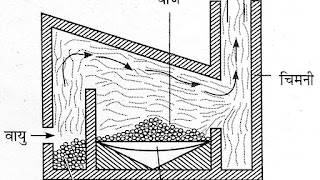
परावर्तनी भट्टी की छत मेहराबदार या अवतलाकार होती है। इस भट्टी के तल पर सांद्रित अयस्क को रखा जाता है तथा इस भट्टी में इंधन को अलग स्थान पर जलाया जाता है ताकि सीधा सान्द्रित अयस्क के सम्पर्क में न हो।
ईंधन को जलाने पर इससे उत्पन्न ज्वाला भट्टी की छत से टकराकर सान्द्रित अयस्क के सम्पर्क में आती है। इससे सांद्रित अयस्क धातु ऑक्साइड में बदल जाता है तथा ज्वालाएं निकास मार्ग से बाहर निकल जाती है।
इस भट्टी में वायु छिद्र होते है।
भर्जन की क्रिया में वायु छिद्रों को खुला रखा जाता है लेकिन निस्तापन क्रिया में वायु छिद्रों को बंद कर देते है।
भर्जन व निस्तापन में अन्तर
|
भर्जन
|
निस्तापन
|
|
1.
यह क्रिया वायु के आधिक्य की उपस्थिति में होती है | |
यह क्रिया वायु की
अनुपस्थिति में होती है | |
|
2.
इस क्रिया द्वारा सल्फाइड अयस्को को धातु ऑक्साइड में परिवर्तित करते है | |
इस क्रिया द्वारा
कार्बोनेट अयस्को एवं जलयोजित ऑक्साइडो को धातु ऑक्साइडो में परिवर्तित करते है | |
|
3.
भर्जन क्रिया में रासायनिक परिवर्तन होता है , जैसे – ऑक्सीकरण आदि | |
निस्तापन क्रिया
में रासायनिक परिवर्तन नहीं होता अर्थात इसमें सांद्रित अयस्क से CO2 , H2O आदि अणुओं का निस्कासन होता है | |
|
4.
उदाहरण :- ZnS + 3O2 → 2ZnO + 2SO2
2PbS + 3O2 → 2PbO + 2SO2
2Cu2S + 3O2 → 2Cu2O + 2SO2
|
उदाहरण :-
ZnCO3 → ZnO + CO2
Al2O3.2H2O → Al2O3 + 2H2O
|
4. धातु ऑक्साइडो का अपचयन
(i) C द्वारा अपचयन (प्रगलन)
(ii) स्वत: अपचयन
(iii) Al द्वारा अपचयन (एलुमिनोथमाईट प्रक्रम)
(iv) विद्युत अपघटनी अपचयन (विद्युत धातुकर्म)
(i) C द्वारा अपचयन (प्रगलन) : भर्जित या निस्तापित अयस्क में अपचायक पदार्थ कार्बन (C) व जालक पदार्थ मिलाकर इसे वात्याभट्टी से तेज गर्म करने से धातु ऑक्साइड अशुद्ध धातु में अपचयित हो जाता है तथा जालक पदार्थ अयस्क में उपस्थित अगलनीय अशुद्धियो से क्रिया करके इसे धातुमल के रूप में पृथक कर देते है अत: धातु ऑक्साइड से अपचयित धातु प्राप्त करने की ये प्रक्रिया प्रगलन कहलाती है।
इसे उताप धातुकर्म (pyro metallurgy ) भी कहते है।
इस विधि द्वारा Pt , Zn , Sn , Fe , Cu आदि धातु ऑक्साइडो का अपचयन करवाया जाता है।
प्रगलन की क्रिया को निम्न प्रकार समझ सकते है –
भर्जित / निस्तापित अयस्क + अगलनीय अशुद्धि + अपचायक + गालक → अपचयित धातु + धातुमल + गैसे
इस विधि में प्रयुक्त होने वाले गालक पदार्थ दो प्रकार के होते है –
(a) अम्लीय गालक
(b) क्षारीय गालक
क्षारीय अशुद्धियो के लिए अम्लीय गालक काम में लेते है तथा अम्लीय अशुद्धियो के लिए क्षारीय गालक काम में लेते है।
क्षारीय अशुद्धि + अम्लीय गालक → धातुमल
अम्लीय अशुद्धि + क्षारीय गालक → धातुमल
P4O10 + 6MgO → 2Mg3(PO4)2
(ii) स्वत: अपचयन : इस विधि द्वारा Cu , Hg , Pb आदि धातुओ के ऑक्साइडो का अपचयन करवाया जाता है। यह धातु ऑक्साइड उच्च ताप पर अस्थायी होते है , अत: इनके अपचयन के लिए कोई अपचायक पदार्थ की आवश्यकता नहीं होती है अर्थात ऐसे धातु ऑक्साइडो को अधिक ताप पर गर्म करने से यह स्वत: ही धातु में अपचयित हो जाते है इसलिए इसे स्वत: अपचयन कहते है।
उदाहरण : Cu2O का अपचयन (बेसेमर प्रक्रम) :-
`2Cu2S + 3O2 → 2Cu2O + 2SO2
2Cu2O + Cu2S → 6Cu + SO2
इसलिए इन धातु ऑक्साइडो की क्रिया सक्रीय Al धातु से करवाकर अपचयित धातु प्राप्त की जाती है ,
Cr2O3 + 2Al → 2Cr + Al2O3
(iv) विद्युत अपघटनी अपचयन (विद्युत धातुकर्म) : इस विधि द्वारा Na , Mg , Al , K , Ca आदि धातुओ के ऑक्साइडो का अपचयन करवाया जाता है।
इस विधि में एक पात्र में धातु ऑक्साइड को गलित अवस्था में लेकर इसमें दो इलेक्ट्रोड लगाकर विद्युत धारा प्रवाहित करते है , इससे विद्युत अपघटन द्वारा कैथोड पर धातु निक्षेपित होती है , इसे विद्युत धातुकर्म भी कहते है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics