zinc magnesium system in hindi phase diagram जिंक मैग्नीशियम तंत्र क्या है चित्र
जिंक मैग्नीशियम तंत्र क्या है चित्र phase diagram of zinc magnesium system in hindi ?
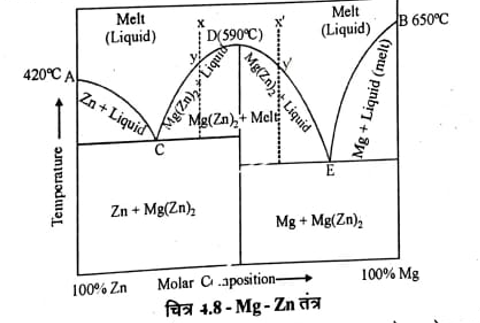
जिंक-मैग्नीशियम तंत्र (Zn-Mg System)
इस तंत्र में सर्वांगसम ताप रखने वाला ठोस यौगिक Mg(Zn), बनता है। शुद्ध जिंक का गलन बिन्दु A (420°C) तथा शुद्ध Mg का गलन बिन्दु B(650°C) है तथा ठोस यौगिक Mg(Zng बनता है इसका गलन बिन्दु D (590°C) है जो दोनों धातुओं के गलन तापक्रम के मध्य है। इसके तंत्र में चार प्रावस्थाऐं है ठोस Zn, ठोस Mg, यौगिक Mg (Zn), तथा Zn व Mg द्रव विलयन है। इस तंत्र का प्रावस्था आरेख चित्र 4.8 में दिखाया गया है।
जब Mg को Zn में मिलाया जाता है तो Zn का गलन बिन्दु वक्र AC के सहारे कम होता है अतः वक्र AC पर कोई बिन्दु ठोस Zn व द्रव Mg (Zn)2 के मध्य साम्यवस्था प्रदर्शित करता है। इसी प्रकार Mg में Zn मिलाने पर Mg का गलन बिन्दु वक्र BE के सहारे कम होता है तथा वक्र BE पर कोई बिन्दु ठोस Mg व द्रव Mg(Zn)2 के मध्य साम्यवस्था प्रदर्शित करता है। बिन्दु C व E गलन क्रांतिक बिन्दु (Eutectic point) है जो अचर है। बिन्दु C पर ठोस Zn, Mg(Zn)2 व द्रव प्रावस्था तथा बिन्दु E पर ठोस Mg, Mg(Zn)2 व द्रव प्रावस्था उपस्थित है।.
बिन्दु D (590°C) पर ठोस Mg(Zn)2 व द्रव Mg(Zn)2 का संघटन एक सा अर्थात् यह तापक्रम यौगिक Mg(Zn)2 का सर्वांगसम गलन ताप होगा। इस बिन्दु पर तंत्र द्विघटक से एक घटक में परिवर्तित हो जाता है व तंत्र अचर है।
जब द्रव मिश्रण को x बिन्दु पर ठण्डा करते है तो तापक्रम xy के सहारे y तक कम होता है तथा y पर ठोस यौगिक Mg (Zn)2 द्रव से अलग हो जाता है तथा यहां तंत्र दो प्रावस्था रखता है अतः इनकी स्वतंत्रता की कोटि एक होगी। y के बाद द्रव वक्र yC के सहारे ठण्डा होगा तथा बिन्दु C के तापक्रम पर द्रव में से ठोस Zn और अलग हो जाऐगा जब बिन्दु C पर तीन प्रावस्थाऐं ठोस Zn. ठोस Mg (Zn)2 व द्रव होगी अतः यह अचर है। इससे अधिक ठण्डा करने पर तीन प्रावस्थाओं के कारण न तो तापक्रम कम होगा और न ही संघटन ।
4.16 असर्वागसम गलनांक वाले यौगिक का बनना
(Compound formation with Incongruent melting point)
ऐसे तंत्र जिसमें दो घटक मिलकर एक यौगिक बनाते हैं जो गर्म करने पर सर्वांगसम वाले के बजाय विघटित होकर कई ठोस प्रावस्था व द्रव बनाते है। व द्रव प्रावस्था का संघटन (Composition) ठोस प्रावस्था से अलग होता है। ऐसे पदार्थ असर्वांगसम गलनांक (Incongruent melting point) रखते हैं। पदार्थ के विघटन को संक्रमण अभिक्रिया या परिक्रांतिक अभिक्रिया (peritectic reaction) कहते हैं। इसे निम्न समीकरण द्वारा व्यक्त करते हैं।
असंर्वागसम गलनांक को संक्रमण ताप या परिक्रान्तिक ताप (meritectic or peritectic tempera ture) कहते हैं।
इस प्रक्रिया में तीन प्रास्थाऐं दो ठोस व एक द्रव (P=3 ) उपस्थित है अतः तंत्र अचर (F= 0) चूंकि तंत्र का ताप स्थिर है अतः सभी प्रावस्थाओं में ताप व संघटन भी स्थिर होगें ।
इन तंत्र का प्रावस्था आरेख चित्र 4.9 में दर्शाया गया है।
माना कि A व B दो घटक है जो संयोगकर AB2 यौगिक बनाते हैं। बिन्दु A व B दो घटकों (पदार्थों) के गलनांक है जबकि बिन्दु D यौगिक AB2 का असर्वागसम गलनांक (Incongruent melting point) या संक्रमण ताप है।
वक्र AC व BD क्रमशः घटक A व B के गलन वक्र (fusion curve) है वक्र AC पर घटक A व द्रव प्रावस्था साम्य में है जबकि वक्र BD पर घटक B व द्रव प्रावस्था साम्य में है। इसी प्रकार वक्र CD भी यौगिक AB, का गलन वक्र है इस पर AB, व द्रव साम्यवस्था में है। बिन्दु D पर यौगिक AB, विघटित
होता है।
AB2(s) ===→ B(s) + द्रव
इसी प्रकार बिन्दु C पर ठोस A. ठोस AB, तथा द्रव ( P = 3) साम्य में है अतः बिन्दु C अचर ( F = 0) है इसको गलन क्रांतिक बिन्दु (Eutectic point) कहते हैं।
वक्र CD को आगे D’ तक बढ़ाया जा सकता है जो सामान्यतः यौगिक AB, का सर्वागसम गलनांक congruent melting point) है यह बिन्दु निमज्जित भूतिष्ठ (Submerged maximum) कहलाता हैं क्योंकि यह वास्तव में नही पाया जाता हैं।
पिकरिक अम्ल–बेन्जीन, गोल्ड – एन्टिमनी, सोडियम – पोटेशियम, सोडियम सल्फेट – जल, सोडियम क्लोराइड जल इस प्रकार के तंत्र के उदाहरण है।
1.17 सोडियम क्लोराइड जल तंत्र (NaCI HO System)
NaCl-H2O का प्रावस्था आरेख चित्र 4.10 में दर्शाया है-
इसमें बिन्दु A जल का हिमांक (0°C) हैं जब इसमें NaCl मिलाया जाता है तो जल का हिमांक कम हो जाता हैं अतः वक्र AB- जल में NaCl मिलाने पर उसके हिमांक अवनभन को प्रदर्शित करता है। इस वक्र के सहारे बर्फ जल के साम्य में है चूंकि प्रावस्था दो है अतः वक्र AB एक चर होगा।
बिन्दु B -21°C पर विलयन संतृप्त हो जाता है एक नई ठोस प्रावस्था NaCl. 2H2O सोडियम क्लोराइड डाइहाइड्रेट अलग हो जाती है। बिन्दु B पर तीन प्रावस्था बर्फ ठोस NaCl. 2H2O तथा विलयन साम्यवस्था में है। अतः बिन्दु अचर (F= 0) है। बिन्दु B को क्रायोहाइड्रिक बिन्दु (Cryohydric Point) या गलन क्रांतिक बिन्दु (Eutectic point) कहते हैं। इस बिन्दु से नीचे तल में ठोस बर्फ व ठोस NaCl.2H2O रहता है।
NaCl के ओर मिलाने पर हिमांक बिन्दु BC के सहारे बिन्दु (0.15°C) तक बढ़ता है। वक्र BC दो प्रावस्थाएं NaCl. 2H2O तथा विलयन उपस्थित है अतः इनकी स्वतंत्रता की कोटि (F= 1) एक हो तथा वक्र BC को विलेयता वक्र (Solubility Curve) कहते हैं।
बिन्दु C पर 0.15°C के ऊपर ठोस NaCl. 2H, O स्थाई नहीं रहता है व निर्जल लवण Nacha विलयन में परिवर्तित हो जाता है।
वक्र CD निर्जल सोडियम क्लोराइड का विलेयता वक्र है तथा यहाँ निर्जल ठोस NaCl व जल, द प्रावस्था साम्य में रहती है। अतः यह एक चर तंत्र है। (F= C – P + 1 = 2-2 + 1 = 1) बिन्दु C पर ठोस NaCl व विलयन का संतृप्त NaCl. 2H2 O का सर्वागसम गलनांक कहलाता है।
क्षेत्र ABCD में NaCl का संतृप्त विलयन है तथा क्षेत्र ABE में दो प्रावस्था बर्फ + – संतृप्त विलयन तथा क्षेत्र CDHG में ठोस NaCl + संतृप्त विलयन तथा क्षेत्र CBFG में दो प्रावस्था, ठोस NaCI2H20+ संतृप्त विलयन है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics