Oxidation Reduction Electrodes or Redox Electrode in hindi ऑक्सीकरण अपचयन या रेडॉक्स इलेक्ट्रोड
ऑक्सीकरण अपचयन या रेडॉक्स इलेक्ट्रोड क्या है चित्र सहित व्याख्या Oxidation Reduction Electrodes or Redox Electrode in hindi ?
धातु-धातु आयन इलेक्ट्रोड (Metal-Metal Ion Electrode) :- इस प्रकार के इलेक्ट्रोडों में एक धातु की छड़ होती है जो कि धातु आयनों के विलयन के सम्पर्क में होती है। यह इलेक्ट्रोड निम्न प्रकार से आरेखित की जाती है-
इस प्रकार के कुछ इलेक्ट्रोड और उनकी इलेक्ट्रोड अभिक्रियायें नीचे दी गई हैं।
ये इलेक्ट्रोड धनायनों के प्रति उत्क्रमणीय होते हैं। अमलगम इलेक्ट्रोड जल से क्रिया करने वाले की स्थिति में धातु का Hg के साथ अमलगम बनाया जाता है। उदाहरण के लिये
धातु-अविलेय लवण इलेक्ट्रोड (Metal-Insoluble Salt Electrode) • इन इलेक्ट्रोडों में धातु के संपर्क में धातु का अल्पतम विलेय लवण तथा लवण का ऋणायन होते हैं। इस प्रकार के इलेक्ट्रोंड़ों में दो प्रमुख है।
(a) सिल्वर – सिल्वर क्लोराइड इलेक्ट्रोड (Silver – Silver Chloride Electrode) : इस इलेक्ट्रोड में एक सिल्वर का तार होता है जो कि HCI के विलयन के सम्पर्क में रहता है, इस प्रकार सिल्वर के तार पर सिल्वर क्लोराइड की परत बन जाती है तथा यह CI के सम्पर्क में होती है। एक सरल सिल्वर – सिल्वर क्लोराइड इलेक्ट्रोड चित्र 6.5 मे दिखाया गया है। इलेक्ट्रोड का आरेख निम्न प्रकार है।
Ag-AgCl इलेक्ट्रोड को सरलता से बनाया जा सकता है इसलिए इस इलेक्ट्रोड का उपयोग संदर्भ इलेक्ट्रोड के रूप में किया जाता है। मानक हाइड्रोजन इलेक्ट्रोड द्वारा Ag-AgCI इलेक्ट्रोड का मानकीकरण कर लिया जाता है।
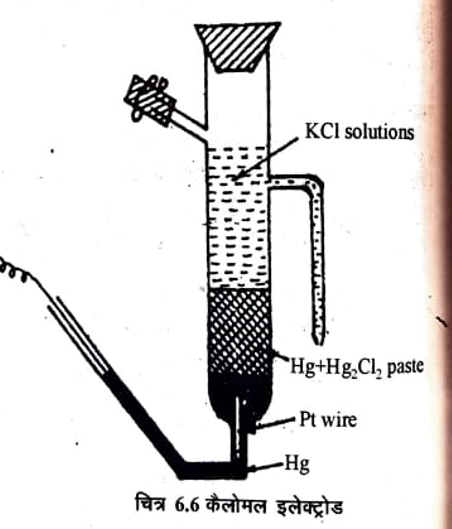
(b) कैलोमल इलेक्ट्रोड – (Calomel Electrode) : इस इलेक्ट्रोड में Hg, मरक्यूरस क्लोराइड (Hg2Cl2 केलोमल) तथा KCI के विलयन के सम्पर्क मे रहता है। इलेक्ट्रोड का आरेख निम्न प्रकार है
एक सरल केलोमल इलेक्ट्रोड चित्र 6.6 में दिखाया गया है। इसमें एक कठोर कांच की नलिका होती है जिसमें दो पार्श्व नलिका तथा पेंदे में एक प्लेटिनम का तार लगा होता है, जिसका कुछ भाग बाहर की ओर निकला रहता है। इस भाग को एक दूसरी नलिका (चित्र में दिखाये अनुसार) से जोड़ दिया जाता है। इस नलिका तथा मुख्य नलिका के शुद्ध Hg भरा होता है। Pt तार द्वारा दोनों नलिका के Hg में विद्युत सम्पर्क रखा जा सकता है। मुख्य नलिका में Hg के ऊपर Hg तथा Hg2 Cl2(s) से बनी लेई भरी रहती है। इसके ऊपर व पार्श्व नली में उपयुक्त सान्द्रता का KCI विलयन भरा रहता है अन्य विलयनों पें से सम्पर्क इसी पार्श्व नली द्वारा बनाया जाता है।
जैसा कि समीकरण (26) से स्पष्ट हे कि Ecal का मान CI- की सक्रियता पर निर्भर करता है, अतः KCI विलयन की भिन्न-भिन्न सान्द्रताऐ लेकर, अनेक विभवों के केलोमल इलेक्ट्रोड बनाये जा सकते हैं। मुख्यतः निम्नलिखित केलोमल इलेक्ट्रोड बनाये गये हैं। जिनके विभव मानक इलेक्ट्रोड विभव के सन्दर्भ में 25°C पर दिये गये हैं
अधिकतर उपयोग में आने वाला इलेक्ट्रोड संतृप्त केलोमल इलेक्ट्रोड (Saturated Calomel Electrode -SCE) है। जिसमें KCI का संतृप्त विलयन काम में लिया जाता है।
ऑक्सीकरण – अपचयन या रेडोक्स इलेक्ट्रोड (Oxidation Reduction Electrodes or Redox Electrode) : इस प्रकार के इलेक्ट्रोड में एक अक्रिय धातु (Pt) का तार ऐसे विलयन के संपर्क मे रखा जाता है जिसमें एक ही धातु की दो भिन्न भिन्न ऑक्सीकरण अवस्थाओं के आयन उपस्थित हों। उदाहरण के लिए-
ग्लास (कांच) इलेक्ट्रोड (Glass Electrode) : ग्लास इलेक्ट्रोड एक विशेष प्रकार के कांच (जिसकी उच्च चालकता और गलनांक अधिक हो) की नली का बना होता है। जिसके एक सिरे को बल्ब का आकार दे दिया जाता है। इस बल्ब में ज्ञात pH का एक विलयन भरा होता है। (सामान्यतया 0.1 MHCI विलयन)। इस विलयन में AgCI की परत चढ़ा हुआ एक Ag का तार डूबा रहता है। (चित्र 6.7 ) । इस इलेक्ट्रोड का आरेख निम्न प्रकार से लिखा जाता है।
इस इलेक्ट्रोड को किसी अज्ञात pH के विलयन में रखा जाता हैं तो नेन्सर्ट समीकरण के अनुसार इसके इलेक्ट्रोड विभव Eg को निम्न व्यंजक द्वारा प्रदर्शित किया जाता है।
इस इलेक्ट्रोड का मुख्य उपयोग अज्ञात विलयन के pH मापन में किया जाता है, देखे खण्ड
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics