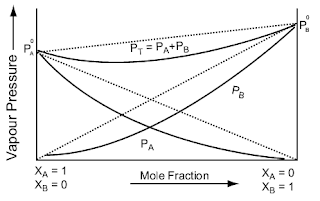
अनादर्श विलयन (non ideal solution in hindi) , अनादर्श विलयन के प्रकार , स्थिर क्वाथी मिश्रण (azeotropic mixture)
अर्थात इन विलयनो का वाष्पदाब राउल्ट के नियम द्वारा ज्ञात किये गए वाष्पदाब के बराबर नहीं होता है।
P ≠ PA + PB
ऐसे विलयन बनते समय या तो ऊष्मा का उत्सर्जन होता है या अवशोषण होता है अर्थात इनमे एन्थैल्पी परिवर्तन का मान शून्य नहीं होता है।
△H ≠ 0
ऐसे विलयन बनते समय विलयन का आयतन विलेय और विलायक के आयतन के योग के बराबर नहीं होता है अर्थात आयतन परिवर्तन का मान शून्य नहीं होता है।
△V ≠ 0
इन विलयनो में A-B अन्तरा आण्विक आकर्षण बलों का परिमाण , A-A आकर्षण बल व B-B आकर्षण के परिमाण के बराबर नहीं होता है।
A-B ≠ A-A व B-B
अनादर्श विलयन के प्रकार
(1) धनात्मक विचलन वाले अनादर्श विलयन : ऐसे अनादर्श विलयन जिनका वाष्पदाब राउल्ट के नियम द्वारा ज्ञात किये गए वाष्पदाब से अधिक होता है , धनात्मक विचलन वाले अनादर्श विलयन कहलाते है।
क्योंकि ऐसे विलयन बनते समय विलेय-विलायक के कणों के मध्य आकर्षण बल (A-B) , विलेय-विलेय के कणों के मध्य आकर्षण बल (B-B) व विलायक-विलायक कणों के मध्य आकर्षण बल (A-A) से दुर्बल होता है। अत: इस कारण वाष्पदाब अधिक बनती है इसलिए इसका वाष्पदाब राउल्ट के नियम द्वारा ज्ञात किये गए वाष्प दाब से अधिक होता है।
धनात्मक विचलन वाले अनादर्श विलयन के लिए आवश्यक स्थितियाँ :
P > PA + PB
△H = +Ve (ऊष्माशोषी)
△V = +Ve (आयतन अधिक)
A-B < A-A व B-B
वक्र :
धनात्मक विचलन वाले अनादर्श विलयन के उदाहरण :
(i) जल + एथेनोल
(ii) जल + मेथेनोल
(iii) एसीटोन + एथेनोल
(iv) एसीटोन + CS2
(v) मेथेनोल + CCl4
(2) ऋणात्मक विचलन वाले अनादर्श विलयन
P < PA + PB
△H = -Ve (ऊष्माक्षेपी)
△V = +Ve (आयतन कम)
A-B > A-A व B-B
वक्र :
स्थिर क्वाथी मिश्रण (azeotropic mixture)
इस मिश्रण का क्वथनांक स्थिर होता है।
इस मिश्रण के घटकों को प्रभाजी आसवन विधि द्वारा भी पृथक नहीं कर सकते है।
इसका वाष्प एवं द्रव दोनों अवस्थाओ में संघटन समान होता है।
स्थिर क्वाथी मिश्रण के प्रकार : यह दो प्रकार के होते है –
(i) अधिकतम वाष्पदाबी या न्यूनतम क्वथनांकी स्थिर क्वाथी मिश्रण
(ii) न्यूनतम वाष्पदाबी या अधिकतम क्वथनांकी स्थिर क्वाथी मिश्रण
(i) अधिकतम वाष्पदाबी या न्यूनतम क्वथनांकी स्थिर क्वाथी मिश्रण : ऐसा स्थिर क्वाथी मिश्रण जिसका क्वथनांक अपने अवयवी घटकों के क्वथनांक से कम होता है , न्यूनतम क्वथनांकी स्थिर क्वाथी मिश्रण कहलाता है।
राउल्ट के नियम से धनात्मक विचलन दर्शाने वाले अनादर्श विलयन ऐसा मिश्रण बनाते है।
उदाहरण : शर्करा के किण्वन से प्राप्त –
एथेनोल (95%) + जल (5%)
(ii) न्यूनतम वाष्पदाबी या अधिकतम क्वथनांकी स्थिर क्वाथी मिश्रण :ऐसा स्थिर क्वाथी मिश्रण जिसका क्वथनांक अपने अवयवी घटकों के क्वथनांक से अधिक होता है , अधिकतम क्वथनांकी स्थिर क्वाथी मिश्रण कहलाता है।
राउल्ट के नियम से ऋणात्मक विचलन दर्शाने वाले अनादर्श विलयन ऐसा मिश्रण बनाते है।
उदाहरण : HNO3 (68%) + जल (32%)
प्रश्न 1 : प्रभाजी आसवन द्वारा प्रयोगशाला में 68% से अधिक सांद्रता का HNO3 नहीं बना सकते , क्यों ?
उत्तर : क्योंकि 68% HNO3 + 32% जल का मिश्रण एक स्थिर क्वाथी मिश्रण का कार्य करता है अत: इसमें उपस्थित जल को प्रभाजी आसवन विधि द्वारा पृथक नहीं कर सकते इसलिए 68% से अधिक सान्द्रता का HNO3 नहीं बना सकते है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics