limitations of henry’s law class 12 chemistry in hindi हेनरी के नियम की सीमाएं लिखिए
हेनरी के नियम की सीमाएं लिखिए limitations of henry’s law class 12 chemistry in hindi ?
हेनरी का नियम ( Henry’s Law)
विलेयता पर दाब का प्रभाव- हेनरी का नियम (Effect of Pressure on Solubility of gases Henry’s law) – विभिन्न दाबों पर गैसों की विलयेता का अध्ययन कर हेनरी ने 1803 में एक नियम प्रतिपादित किया जिसे हेनरी का नियम (Henry’s law) कहते हैं। इस नियम के अनुसार- स्थिर ताप पर विलायक के किसी दिए हुए आयतन में घुली हुई गैस की मात्रा साम्यवस्था पर उस पर डाले गए दाब के समानुपाती होती है। यदि गैस विलायक से कोई रासायनिक क्रिया न करें। यदि m स्थिर ताप पर विलायक के दिये हुऐ आयतन में घुली हुई गैस की मात्रा हो तथा साम्यावस्था पर P गैस का दाब हो तो,
m ∞ P
m = kp ………………………(15)
यहाँ k एक समानुपाती स्थिरांक है इसे हेनरी स्थिरांक भी कहते हैं जिसका परिमाण गैस की प्रकृति, विलायक की प्रकृति, ताप दाब के मात्रक पर निर्भर करता है। घुली हुई गैस की मात्रा विलयन में गैस की सान्द्रता के अनुरूप ली जा सकती है। चूंकि गैस की सान्द्रता इसकी मोल भिन्न (x) के समानुपाती
होती है। अतः हेनरी नियम को निम्नप्रकार भी व्यक्त किया जा सकता है-
X ∞ P
x= kp ………….(16)
जहां k’ एक नया समानुपातिक स्थिरांक है जो कि हेनरी स्थिरांक k से निम्न प्रकार संबंधित है-
……….(17)
अधिकांशतः हेनरी को समीकरण (15) के स्थान पर समीकरण ( 17 ) से व्यक्त किया जा सकता है।
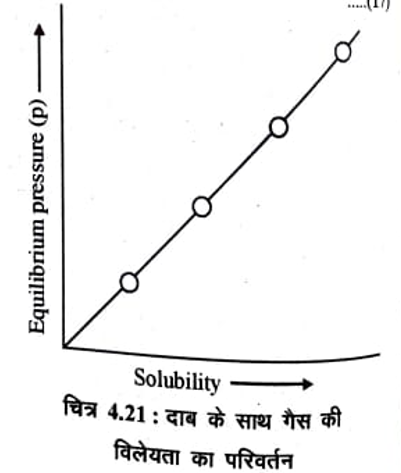
समीकरण (15) एक सरल रेखा की समीकरण है जो मूल बिन्दु (origin) से गुजरती है। यदि हेनरी नियम सही (valid ) है तो गैस की विलेयता तथा दिए गए ताप पर साम्य दाब (Equilibrium pressure) के मध्य ग्राफ खींचने पर चित्र 4.21 के अनुसार एक सरल रेखा प्राप्त होनी चाहिए।
सारणी चित्र 49 में 298 K पर ऑक्सीजन गैस की विलेयता पर दाब का प्रभाव प्रदर्शित किया गया है।
हेनरी के नियम को एक दूसरे रूप में भी व्यक्त किया जा सकता है। जिसमें घुली हुई गैस की मात्रा के स्थान पर उसका आयतन सन्निहित होता हैं मान लीजिये कि ताप T पर M अणुभार वाली m ग्राम गैस जिसका आयतन V मिली है, साम्य दाब p पर विलायक के किसी आयतन में घुली हुई है। गैस समीकरण के अनुसार-
हेनरी के नियमानुसार m/P स्थिरांक है तथा किसी गैस के लिये स्थिर ताप पर RT/M का मान भी स्थिर होता है।
अतः V = स्थिरांक …..(19)
इस प्रकार निश्चित ताप पर विलायक के किसी दिये हुये हुए आयतन में घुली हुई गैस का आयतन दाब पर निर्भर नहीं करता है। हेनरी नियम के अनुसार किसी गैस की विलेयता उसके आंशिक दाब के समानुपाती होती है। इसकी पुष्टि हेतु जब कार्बोनेटीकृत शीतल पेय अथवा सोडा वाटर की बोतल को खोला जाता है तो गैस के बुलबुले बाहर निकलते हैं। जब बोतल बन्द होती है तो कार्बन डाई ऑक्साइड का आंशिक दाब उच्च होता है जिससे हेनरी के नियमानुसार गैस की विलेयता अधिक होती है अर्थात् अधिक मात्रा मे गैस घुली रहती है। लेकिन ज्योंहि बोतल खुलती है बोतल के भीतर वायु प्रवेश करती है जिससे कार्बन डाई ऑक्साइड का आंशिक दाब घट जाता है इसके कारण CO2 की विलेयता कम हो जाती है और विलेयता कम होने से अतिरिक्त घुली हुई गैस बुलबुलों के रूप में बाहर निकलती है।
इसी प्रकार शीतल पेय की बहुत ठण्डी बोतल को खोलने पर गैस के बहुत कम बुलबुले बाहर निकलते है या फिर गैस बाहर नहीं निकलती। इसका कारण कि स्थिर दाब पर ताप बढ़ाने पर गैस की किसी विलायक में विलेयता कम होती जाती है व ताप घटाने पर गैस की विलायक में विलेयता बढ़ती है। अतः बहुत ठण्डी बोतल का ताप बहुत कम होने से घुली हुई गैस CO2 बाहर नहीं निकलती या बहुत कम निकलती है।
हेनरी के नियम की सीमाएं (Limitations of Henry’s law) – द्रवों में गैसों की विलेयता के परिणामों से स्पष्ट है कि केवल निम्न अवस्थाओं में ही हेनरी नियम लागू होता है।
(i) दाब उच्च न हो
(ii) ताप अत्यन्त निम्न न हो ।
(iii) विलयन तनु हो अर्थात् गैस की विलेयता विलायक में कम हो।
(iv) विलयन एवं गैस दोनों प्रावस्थाओं में गैस के अणुओं की स्पीशीज समान हो अर्थात् गैस विलयन से कोई अभिक्रिया नहीं करें तथा विलायक में न तो आयनिक हो और न ही संगुणित हो।
HCI, NH3 आदि गैसों के लिये यह नियम असफल हो जाता है क्योंकि ये गैस जल से रासायनिक अभिक्रिया करती है परन्तु बेंजीन में HCI तथा NH3 गैसों की विलेयता के लिये यह नियम लागू होता है ।
जब एक विलायक में कई गैसों के मिश्रण को घोला गया हो तब हेनरी का नियम मिश्रण में उपस्थित प्रत्येक गैस के लिये स्वतंत्र रूप से (Independently) लागू होता है। अर्थात् प्रत्येक गैस की विलेयता मिश्रण में उसके आंशिक दाब के समानुपाती होती है तथा हेनरी स्थिरांक k का मान अलग-अलग गैसों के लिये अलग-अलग होता है।
हेनरी के नियम की श्वसन क्रिया में उपयोगिता (Henry’s law & its application to respiration) श्वसन क्रिया मे प्राणी वायुमण्डल से वायु ग्रहण करता है। वायु श्वसन नली द्वारा फेफड़ों में उपस्थित कूपिका (Alveoli) में पहुँचती है। सांस लेते समय ग्रहण की गई वायु की मात्रा, वायुमण्डल दाब व कूपिका के वायुदाब के अन्तर के समानुपाती होती है।
यहाँ Patm तथा Paly क्रमशः वायुमण्डल तथा कूपिका के वायुदाब है तथा F ग्रहण की गई वायु की मात्रा (Bulk flow of air ) है ।
कूपिका से वायु कोशिकाओं (Cells) तथा उत्तकों (tissue) में पहुँचती है। यहाँ वायुमण्डलीय ऑक्सीजन पतली केश नलिकाओं में प्रवाहित हो रहे रूधिर के लगभग सम्पर्क में आती है। यहाँ आक्सीजन का रूधिर में अवशोषण तथा रूधिर में उपस्थित कार्बन डाइऑक्साइड का कूपिका में विसरण होता है।
रूधिर में ऑक्सीजन का अवशोषण वायु में उपस्थित ऑक्सीजन के आंशिक दाब पर निर्भर करेगा। हेनरी के नियम अनुसार-द्रव में घुलने वाली गैस की मात्रा गैस के आंशिक दाब के समानुपाती है। अर्था ऑक्सीजन का आंशिक दाब अधिक होगा तो ऑक्सीजन रूधिर में अधिक अवशोषित होगी। अधिक ऊँचाई पर वायुमण्डलीय दाब कम हो जाता है, साथ ही वायुमण्डल में उपस्थित ऑक्सीजन का आंशिक दाब भी घट जाता है। इस प्रकार हेनरी के नियम के अनुसार रूधिर में ऑक्सीजन की कम मात्रा अवशोषित होगी।
रूधिर को पर्याप्त मात्रा में ऑक्सीजन नहीं मिलने पर सांस जल्दी-जल्दी लेनी होगी और प्राणी जल्दी हॉफ जायेगा। इसलिये पर्वतारोही अपने साथ ऑक्सीजन मास्क ले जाते है ताकि आवश्यकता होने पर ऑक्सीजन का आंशिक दाब बढ़ाया जा सके। इस कठिनाई से बचने के लिये वायुयानों तथा अंतरिक्षयानों में वायुमण्डलीय दाब बनाये रखा जाता है।
इसी प्रकार गोताखोर को थोड़ी-थोड़ी देर बाद जल की सतह पर आना पड़ता है; क्योंकि पानी में उच्च दाब होने पर CO2 का उत्सर्जन पूरा नहीं हो पाता, परिणामस्वरूप CO2 अधिक समय तक रूधिर में घुली रहती है। और बैचेनी होने लगती है। सतह पर आने से दाब में कमी हो जाती है। यदि CO2 को अधिक देर तक रूधिर में घुला रहने दिया जाता है तो गोताखोर को देह बंकन ( Bend) की बीमारी हो जाती है जो कि प्राणघातक भी हो सकती है। ऑक्सीजन की घुलनशीलता समुद्री जल की तुलना में शुद्ध जल में अधिक होती है।
आंशिक रूप से मिश्रणीय द्रव तंत्र (Partially Miscible Liquid System)
यदि दो द्रव एक दूसरे में आंशिक रूप से मिश्रणीय होते है तो विलेयता की एक निश्चित सीमा के बाद दो परतें (Layers) पृथक हो जाती है। ये तीनों परतें एक द्रव का दूसरे में विलयन होती है। इस प्रकार से प्राप्त दो विलयन संयुग्मी विलयन (Conjugate Solutions) कहलाते हैं। इन संयुमी विलयनों का संघटन (Composition) ताप के साथ परिवर्तित होता है, क्योंकि ताप परिवर्तन से दोनों द्रवों की पारस्परिक विलेयता (Mutual solubility) बदलती है इस आधार पर इन द्रव-युग्मों को दो भागों में बांटा जा सकता है।
(a) एक वे द्रव-युग्म हैं, जिनकी पारस्परिक विलेयता ताप बढ़ाने से बढ़ती है। एक निश्चित ताप अथवा उससे अधिक ताप पर ये द्रव एक दूसरे में पूर्णतः मिश्रणीय (Completely miscible) हो जाते हैं।
यह निश्चित ताप इन द्रव-युग्मों का क्रान्तिक विलयन ताप (Critical Solution Temperature) अथवा संवलियन ताप (Consolute Temperature) कहलाता है। चूंकि यह ताप सामान्य से अधिक होता है, अतः इसे उच्च संविलयन ताप (Upper Consolute Temperature) भी कह सकते हैं। फीनोल-जल, ऐनिलीन हेक्सेन, ऐनिलीन-जल आदि इस प्रकार के द्रव – युग्मों के उदाहरण हैं।
(b) दूसरे वे द्रव युग्म है, जिनकी पारस्परिक विलयेता ताप घटाने से बढ़ती है। एक निश्चित निम्न ताप पर ये पूर्ण रूप से मिश्रणीय हो जाते हैं। यह निश्चित ताप इन द्रव-युग्मों के लिये क्रान्तिक विलयन ताप अथवा संविलयन ताप कहलाता है। चूंकि यह ताप सामान्य से कम है, अतः इसे निम्न संविलयन ताप भी कह सकते हैं। जल-निकोटिन, मेटा-टॉलूइडीन-ग्लीसरोल आदि इन द्रव युग्मों के उदाहरण है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics