Hess’s Law of Constant Heat Summation in hindi hess हेस का स्थिर ऊष्मा संकलन का नियम समझाइए।
हेस का स्थिर ऊष्मा संकलन का नियम समझाइए। Hess’s Law of Constant Heat Summation in hindi hess ?
ऊष्मा रसायन के नियम (Laws of Thermochemistry) रासायनिक अभिक्रियाओ में होने वाले ऊष्मा परिवर्तन के दो नियम है जिन्हें ऊष्मा रसायन के नियम कहते हैं । ये नियम ऊष्मागतिकी के प्रथम नियम (ऊर्जा संरक्षण नियम) पर आधारित है।
1. लाब्याज्ये एवं लाप्लास नियम (Lavoisier and Laplace Law)– इस नियम के अनुसार, “एक रासायनिक प्रक्रम में अवशोषित अथवा उत्सर्जित ऊष्मा का मान, विपरीत रासायनिक प्रक्रम में उत्सर्जित अथवा अवशोषित ऊष्मा के मान के बराबर होगा।” अतः किसी यौगिक की संभवन ऊष्मा (ऐन्थेल्पी) का मान उसकी अपघटन ऊष्मा के मान के बराबर होगा, परन्तु उसका चिन्ह विपरीत होगा ।
उदाहरण के लिये
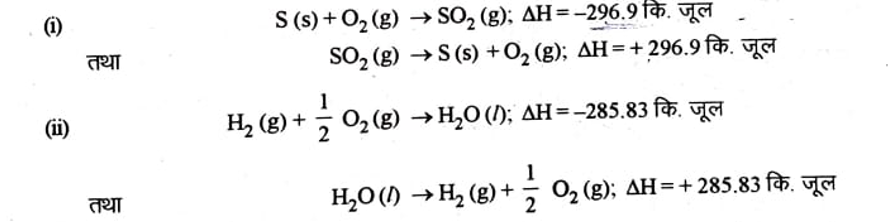 2. हैस का स्थिर ऊष्मा संकलन नियम (Hess’s Law of Constant Heat Summation)-
2. हैस का स्थिर ऊष्मा संकलन नियम (Hess’s Law of Constant Heat Summation)-
हैस ने 1840 में इस नियम का प्रतिपादन किया था। इस नियम के अनुसार “कोई रासायनिक प्रक्रम दो या दो से अधिक विधियों द्वारा सम्पन्न हो सकता है, परन्तु प्रक्रम में होने वाला ऊष्मा परिवर्तन या ऐन्थेल्पी परिवर्तन समान होगा।” अर्थात् ऊष्मा परिवर्तन प्रक्रम की प्रारम्भिक एवं अन्तिम अवस्था पर निर्भर करता है, न कि उस पथ पर जिससे प्रक्रम गुजरता है
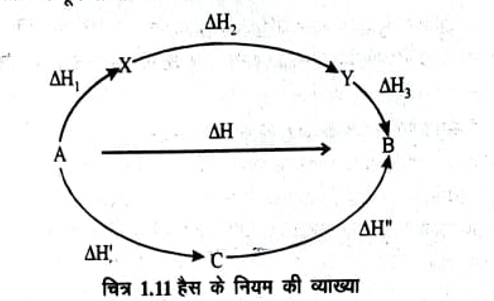
A → B एक रासायनिक प्रक्रम है। चित्र 1.11 में दिखाये अनुसार यह प्रक्रम अलग-अलग पदों 7 में सम्पन्न होता है। एक में A से B में सीधा परिवर्तन होता है तथा अवशोषित ऊष्मा H है।
दूसरे में A पहले C में और फिर B में परिवर्तित होता है। इन पदों में अवशोषित ऊष्मा क्रमश: H व H” हैं इसी प्रकार तीसरे में A पहले X में फिर Y में और अन्त में B में परिवर्तित होता हैं इन पदों में क्रमशः H1, H2 तथा H3 ऊष्मा अवशोषित होती हो तो हैंस के नियम के अनुसार-
इस प्रकार प्रक्रम में पूर्ण ऊष्मा परिवर्तन समान होगा।
हैस के नियम की व्याख्या हैस नियम की वैधता (Validity of Hess’s Law) – हैस नियम की वैधता समझने के लिये परोक्ष विधि अपनाई जाती है। ऊष्मा मान लीजिये कि (H’ + H”) > H – अब A को सीधे B में परिवर्तन कर देते हैं तो अवशोषित • ऊष्मा का मान H होगा। यदि B को वापस A में परिवर्तन C के माध्यम से करते हैं तो उत्सर्जित का मान (H’ + H”) होगा। इस प्रकार एक चक्र में (H’ + H”) – H ऊष्मा प्राप्त होगी। इस प्रकार एक चक्रों की पुनरावृत्ति करके असिमित ऊष्मा प्राप्त की जा सकती है चूंकि यह ऊर्जा संरक्षण के नियम के विरूद्ध है, अतः (H’ + H”) का मान H से अधिक नहीं हो सकता। इसी प्रकार यदि (H’ + H”) < H तो प्रत्येक चक्र में ऊर्जा व्यय होगी। जो कि फिर ऊर्जा संरक्षण के नियम के विरूद्ध है। अतः यह निष्कर्ष निकलता है कि H = H’ + H”
हैस के नियम को समझने के लिये निम्नलिखित उदाहरण पर ध्यान दीजिये माना कि NH3 तथा HCI द्वारा NH4CI का जलीय विलयन बनना एक प्रक्रम है यह प्रक्रम दो विधियों द्वारा सम्पन्न हो सकता है।
प्रथम विधि- NH3 तथा HCI द्वारा ठोस NH4 Cl बनाये और उसे जल में घोले। इन दो पदों में ऊष्मा परिवर्तन इस प्रकार है-
द्वितीय विधि- इस विधि में NH3 (g) तथा HCl (g) का पहले जलीय विलयन बनाते हैं फिर दोनों के जलीय विलयन को मिला कर NH4CI का जलीय विलयन प्राप्त करते हैं। इन तीन पदों में ऊष्मा परिवर्तन इस प्रकार है-
जोड़ने पर-
HCl (g) + NH3 (g) + aq = NH4Cl (aq); H = -161.48 कि. जूल
इस प्रकार दोनों विधियों में उत्पन्न होने वाली ऊष्मा का मान समान है जो कि हैस नियम के अनुरूप
हैस नियम के अनुप्रयोग (Applications of Hess’s Law)-
कुछ ऐसी रासायनिक क्रियाऐं होती हैं जिसमें होने वाला ऊष्मा परिवर्तन सीधे नहीं मापा जा सकता अतः परोक्ष विधियों से ऊष्मा परिवर्तन हैस नियम का उपयोग करके ज्ञात किया जाता है। नियम के परिणामस्वरूप ऊष्मा रासायनिक समीकरणों को बीजीय समीकरणों के समान ही जोड़ा या घटाया जा सकता है तथा किसी गुणांक से गुणा, भाग किया जा सकता है। इस नियम का उपयोग करके संभवन ऊष्मा, संक्रमण ऊष्मा आदि की गणना की जा सकती है। परोक्ष विधियों से आयनिक यौगिकों की जालक ऊर्जा एवं अधातुओं की इलेक्ट्रॉन बंधुता ऊष्मा गतिकी चक्र “बोर्न हेबर चक्र” (Born Haber’s cycle) द्वारा ज्ञात की जाती है। यह चक्र भी हैस नियम पर ही आधारित है।
निम्नलिखित उदाहरणों से इसकी उपयोगिता का अनुमान लगाया जा सकता है।
बंध की पूर्ण ऊष्मा या बन्ध ऊर्जा (Bond Enthalpy or Bond Energy)
रासायनिक अभिक्रिया में वस्तुतः परमाणुओं के बीच के बन्ध टूटते हैं तथा अन्य परमाणुओं के मध्य बन्ध बनते हैं। बंधों के टूटने में ऊर्जा अवशोषित होती है, जबकि बन्धों के बनने में ऊर्जा मुक्त होती है।
“एक मोल पदार्थ के अणुओं में कोई बन्ध विशेष तोड़ने के लिये आवश्यक न्यूनतम ऊर्जा उस बन्ध की बन्ध ऊर्जा या बन्ध एन्यैल्पी कहलाती है । ”
एक मोल पदार्थ में अणुओं की संख्या 6.02 × 1023 होती है। अतः सभी अणुओं में बन्ध विशेष से संख्या भी 6.02 × 1023 होगी। इन सभी बन्धों को तोड़ने के लिये आवश्यक ऊर्जा पदार्थ की बन्ध ऊर्जा
होती है ।
द्वि– परमाणुक अणु की बन्ध ऊर्जा का मान उस अणु की वियोजन ऊष्मा के बराबर होती है। Cl2 अणु का वियोजन निम्न प्रकार दिखाया जाता है।
Cl2(g) = 2C1 (g); H = 243 कि. जूल
चूंकि CI-CI बंध के टूटने पर ही CI परमाणु प्राप्त होते हैं, अतः CL की बन्ध ऊर्जा भी 243.0 कि. जूल होगी। इसी प्रकार HCl (g) के वियोजन की ऊष्मा H-CI बन्ध ऊर्जा होगी।
HCl(g) = H (g) + C1 (g) ; H = 24.6 कि. जूल
बहु परमाणुक अणु में एक से अधिक बन्ध होते हैं । जिसे बन्ध विशेष को तोड़ा जाता है, उसके लिये आवश्यक ऊर्जा शेष भाग की प्रकृति पर निर्भर करती है। अतः समान बन्धों की ऊर्जाओं के मान भी भिन्न-भिन्न होते हैं। उदाहरण के लिये H2O (g) से एक O-H बन्ध तोड़ने के लिये आवश्यक ऊर्जा 497.8 कि. जूल है, जबकि OH (g) से O-बन्ध तोड़ने के लिये आवश्यक ऊर्जा 428.5 कि. जूल है।
H2O(g) = H (g) + OH (g); H = 498.8 कि. जूल
OH (g) = H (g) + O (g); H = 428.5 कि. जूल
इस स्थिति में बन्ध ऊर्जा को औसत बन्ध ऊर्जा कहना उपयुक्त है अतः H2O में OH बन्धकी
औसत बन्ध ऊर्जा = 497.8+428.5 /2
= 463.2 कि. जूल
मेथेन गैस को उसके परमाणुओं में विघटित करने के लिये आवश्यक ऊर्जा का मान 1664.7 कि. जूल है
CH4 (g) = C (s) + 4H (g); H = 1664.7 कि. जूल
दूसरे शब्दों में यह ऊर्जा चार C-H बन्धों को तोड़ने के लिये आवश्यक है।
अतः C-H की औसत बन्ध ऊर्जा = 1664.7 /4 = 416.17 कि. जूल
यहाँ यह ध्यान रखना आवश्यक है कि CH के विघटन (परमाणुकरण) की ऊर्जा CH4 की संभवन ऊष्मा के मान का चिन्ह विपरीत करके प्राप्त की जा सकती है।
बन्ध ऊर्जाओं के अनुप्रयोग (Applications of Bond Energies) (i) अभिक्रिया ऊष्मा का परिकलन (Calculation of Heat of Reaction)
बन्ध ऊर्जाओं का उपयोग अभिक्रिया ऊष्मा ज्ञात करने में किया जा सकता है। इस कार्य के लिये अभिकारक एवं उत्पादों की संरचना ज्ञात होना आवश्यक है ।
अभिक्रिया ऊष्मा का परिकलन निम्नलिखित उदाहरण द्वारा समझा जा सकता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics