carnot cycle in hindi definition diagram explain कार्नो चक्र की परिभाषा क्या है समझाइये चित्र
कार्नो चक्र की परिभाषा क्या है समझाइये चित्र carnot cycle in hindi definition diagram explain ?
ऊष्मागतिकी -II (THERMODYNAMICS-II)
विषय प्रवेश (Introduction)
ऊष्मागतिकी का प्रथम नियम यद्यपि अपने में परिपूर्ण है परन्तु फिर भी इसकी कुछ निम्नलिखित सीमाएं है-
1. ऊष्मागतिकी का प्रथम नियम तन्त्र द्वारा अवशोषित ऊष्मा तथा किये गये कार्य में सम्बन्ध बताता है परन्तु ऊष्मा के प्रवाह की दिशा के बारे में नहीं बताता है।
2. प्रथम नियम के अनुसार किसी विलगित तन्त्र की अवस्था परिवर्तन में उसकी ऊर्जा स्थिर रहती है । परन्तु यह नियम इस बात पर कोई प्रकाश नहीं डालता कि अवस्था परिवर्तन स्वतः होती है या नहीं अथवा परिवर्तन संभव है या नहीं।
3. प्रथम नियम के अनुसार एक प्रकार की ऊर्जा तुल्य मात्रा की दूसरे प्रकार की ऊर्जा में परिवर्तित हो जाती है। परन्तु प्रथम नियम यह नहीं बताता कि ऊष्मा को बिना अन्यत्र परिवर्तन किये, तुल्य मात्रा के कार्य में पूर्णतया परिवर्तित नहीं किया जा सकता।
प्रथम नियम की इन कमियों को दूर करने के लिये ऊष्मागतिकी का द्वितीय नियम प्रतिपादित किया गया है। ऊष्मागतिकी के द्वितीय नियम की सहायता से उष्मा के प्रवाह की दिशा, रासायनिक प्रक्रमों के स्वतः होना, साम्यवस्था प्राप्ति के लिए आवश्यक परिस्थिति आदि के बारे में जानकारी की जा सकती है। द्वितीय नियम द्वारा ऊष्मा की अधिकतम मात्रा जो कि कार्य में परिवर्तित होती है, की गणना भी की जा सकती है।
स्वतः अथवा अनुत्क्रमणीय प्रक्रम (Spontaneous or Irreversible Process)
पिछले अध्याय में बताया जा चुका है कि यदि किसी गैस का प्रसार उसके दाब के अनन्तसूक्ष्म कम प्रतिरोधी दाब के विरूद्ध होने दिया जाता है तो प्रसार उत्क्रमणीय (Reversible) होता है तथा किया गया कार्य अधिकतम होता है। यदि गैस के दाब व प्रतिरोधी दाब में अन्तर अधिक अथवा गैस का प्रसार तेजी सेहो तो गैस का प्रसार अनुत्क्रमणीय कहलाता है तथा किया गया कार्य कम होता है। किसी निकाय में बिना किसी बाह्य साधन की सहायता से होने वाले प्रक्रम स्वतः या स्वाभाविक प्रक्रम (sponta neous) कहलाते हैं। यह पाया गया है कि प्राकृतिक प्रक्रम (Natural process) स्वतः एवं अनुत्क्रमणीय होते हैं। कुछ उदाहरण निम्नलिखित है-
1.जल उच्च तल से नीचे तल की ओर स्वतः प्रवाहित होता है। प्रवाह की दिशा को बिना किसी बाह्य कार्य के विपरीत नहीं किया जा सकता ।
2. ऊष्मागर्म वस्तु से ठंडी वस्तु की ओर स्वतः प्रवाहित होती है जब तक की दोनों का तापमान एक समान नहीं हो जाए। यदि प्रक्रम को उल्टा किया जाता है तो ऊर्जा की आवश्यकता होती है।
3. विद्युत धारा उच्च विभव से कम विभव की ओर प्रवाहित होती है।
4. कॉपर धातु को यदि सिल्वर नाइट्रेट विलयन में डाला जाता है तो Cu स्वतः घुलता है तथा Ag अवक्षेपित होती है।
Cu(s) + 2AgNO3(aq) → Cu(NO3)2 (aq) + 2Ag(s)↓
5. एक अर्द्धपारगम्य झिल्ली द्वारा विलायक के अणुओं का कम सान्द्रता के विलयन से अधिक
सान्द्रता के विलयन में अभिगमन (परासरण प्रक्रिया) एक स्वतः प्रक्रिया है। इस प्रक्रिया क विपरीत दिशा में करने के लिये यांत्रिक दाब की आवश्यकता होती है।
6. एक गैस उच्च दाब से निम्न दाब या निर्वात की ओर स्वतः प्रसारित होती है।
सभी स्वतः प्रक्रमों से कार्य प्राप्त किया जा सकता है। चूंकि ये प्रक्रम अनुत्क्रमणीय होते हैं अत उत्क्रमणीय प्रक्रमों की तुलना में (अधिकतम कार्य ) इन प्रक्रमों से प्राप्त कार्य बहुत कम होता है।
ऊष्मागतिकी के द्वितीय नियम के विभिन्न कथन (Different statements of Second law of Thermodynamics)
उपरोक्त विवेचना के आधार पर केल्विन (Kelvin, 1850) ने ऊष्मागतिकी के द्वितीय नियम की निम्न परिभाषा दी –
उच्च ताप के ऊष्मा भंडार से निम्न ताप के ऊष्मा भंडार को कुछ ऊष्मा स्थानान्तरित किये बिना, एक चक्रीय प्रक्रम द्वारा, उसी समय ऊष्मा को कार्य में परिवर्तित करना संभव नहीं है। ऊष्मागतिकी के द्वितीय नियम को निम्न प्रकार भी परिभाषित किया जा सकता है-
केवल एक ऊष्मा श्रोत से जुड़े एक तंत्र से, एक चक्रीय प्रक्रम द्वारा पारिपार्श्विक पर कुछ कार्य संभव नहीं है। अर्थात् कार्य की सतत प्राप्ति के लिये सिंक का होना आवश्यक है।
द्वितीय नियम को निम्न शब्दों में भी व्यक्त किया जा सकता है-
एक तंत्र के किसी भाग अथवा पारिपार्श्विक में परिवर्तन हुये बिना, ऊष्मा को तुल्य मात्रा के कार्य में रूपान्तरित करना असंभव होता है।
अर्थात् किसी भी चक्रीय प्रक्रम में किसी स्त्रोत से ग्रहण की गई ऊष्मा अपने कुछ भाग का हनन किए बिना तुल्य मात्रा में कार्य में परिवर्तित नहीं हो सकती।
क्लासियस (Clausius) ने रेफ्रिजरेटर के सिद्धान्त पर ऊष्मागतिकी के द्वितीय नियम को निम्न प्रकार से परिभाषित किया है-
किसी भी स्वतः क्रियाशील मशीन के लिये, जिसे किसी अन्य बाह्य श्रोत की सहायता प्राप्त न हो, निम्न ताप वाली वस्तु से ऊष्मा लेकर अपेक्षाकृत गर्म वस्तु को प्रदान करना असम्भव है।
अथवा
ऊष्मा अपने आप निम्न ताप की वस्तु से उच्च ताप की वस्तु की ओर प्रवाहित नहीं हो सकती ।
ऊष्मा का कार्य में परिवर्तन(Conversion of Heat in to Work)
सामान्य अनुभव के आधार पर यह कहा जा सकता है कि प्रत्येक प्रकार की ऊर्जा की स्वाभाविक प्रकृति ऊष्मा में परिवर्तित होने की होती है। परन्तु ऊष्मा की कार्य में परिवर्तित होने की स्वाभाविक प्रकृति नहीं पायी जाती। यह परिवर्तन किसी यांत्रिक विधि द्वारा ही संभव है। यह यांत्रिक विधि साधारणतया ऊष्मा इंजन (Heat Engine) कहलाती है। जैसा की पिछले अध्याय में वर्णन किया गया है, एक समतापी (Isothermal) उत्क्रमणीय चक्रीय प्रक्रम में शुद्ध ऊष्मा अवशोषित नहीं होती क्योंकि तंत्र एवं पारिपार्श्विक प्रारम्भिक अवस्था में ही वापस आ जाते हैं। अतः कार्य भी शून्य होगा ।
माना कि एक गैसीय तंत्र ऊष्मा अवशोषित करके कुछ प्रसार कार्य करता है। यदि तंत्र पर समान मात्रा में सम्पीडन कार्य किया जाये तो ऊष्मा, निकलती है परन्तु प्राप्त ऊष्मा अवशोषित ऊष्मा से कम होती है। इससे इस बात की पुष्टि होती है कि अवशोषित हुई ऊष्मा पूर्ण रूप से कार्य में परिवर्तित नहीं हुई थी। अतः यह निश्चित है कि ऊष्मा को पूर्णतः कार्य में परिवर्तित नहीं किया जा सकता उसका एक अंश ही कार्य में परिवर्तित होता है। शेष अंश तंत्र के अणुओं की अनियमित गति (Random motion) बढ़ाने में काम आता है। यही अनियमित गति ऊष्मा को पूर्णतः कार्य में परिवर्तित नहीं होने देने के लिये उत्तरदायी है।
कार्नो चक्र (Carnot Cycle)
यह एक ऐसा चक्र है जिसमें कोई तंत्र कुछ उत्क्रमणीय प्रक्रमों से गुजरते हुए अपनी मूल अवस्था । में लौट जाता है। सर्वप्रथम 1824 में फ्रांसीसी वैज्ञानिक सादी कार्नो ने इस चक्र का अध्ययन करके ऊष्मा को यांत्रिक कार्य में बदलने की युक्ति बनाई जिसे ऊष्मा इंजन कहते हैं।
कार्नो ने सिद्ध किया कि आदर्श अवस्थाओं में भी ऊष्मा का एक निश्चित प्रतिशत ही कार्य में परिणित हो सकता है। वास्तविक ऊष्मा इंजन पूर्ण उत्क्रमणीय नहीं होते क्योंकि घर्षण, चालन, विकिरण आदि से ऊष्मा हानि को पूर्णतया रोक पाना संभव नहीं होता है ।
ऊष्मा के अधिकांश अंश को कार्य में परिवर्तित करने के लिये कार्नो ने चक्रीय प्रक्रम का वर्णन किया है जो कि कार्नो चक्र या कार्नो का आदर्श इंजन कहलाता है।
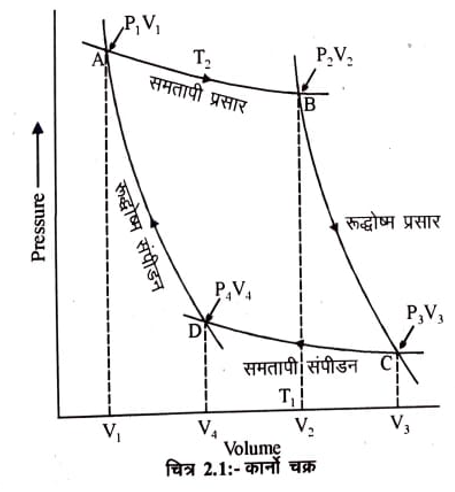
इसे समझने के लिये एक गैसीय तंत्र लेते हैं। एक भारहीन व घर्षणहीन पिस्टन युक्त सिलिंडर में एक मोल आदर्श गैस भरी हुई है। यह एक काल्पनिक ऊष्मा इंजन है जो कि दो ऊष्मा भंडार (Reservoirs) के बीच कार्य करता है। एक का ताप T1 है जो कि स्त्रोत (Source) का कार्य करता है तथा दूसरे का ताप T2 है जो कि सिंक (Sink) की तरह कार्य करता है। वह तन्त्र ऊष्मा भंडार अथवा ऊष्मा कुण्ड (Heat reservvior) कहा जाता है जिसका ताप तन्त्र के प्रत्येक भाग में समान होता है। इस तंत्र से कुछ ऊष्मा लेने अथवा ऊष्मा देने पर उसके ताप में कोई परिवर्तन नही होता। यदि ऊष्मा भंडार से ऊष्मा ली जाती है तो वह स्त्रोत (Source) का कार्य करता है। यदि ऊष्मा भंडार को ऊष्मा दी जाती है तो सिंक (Sink) का कार्य करता है। कार्नो का सम्पूर्ण चक्र चार उत्क्रमणीय पदों में सम्पादित (पूर्ण) होता है। इन पदों से गुजरकर तंत्र अपनी मूल अवस्था में लौट आता है। चक्र को चित्र 2.1 में प्रदर्शित किया गया है।
पद-1 समतापी प्रसार (Isothermal expansion)– तंत्र को T2 ताप वाले स्त्रोत के सम्पर्क में जाता है (बिन्दु A) यहाँ ऊष्मा q2, अवशोषित होती है तथा गैस का समतापी उत्क्रमणीय रूप से ! आयतन V1 से V2 तक होता है (बिन्दु A से बिन्दु B)। चूंकि प्रसार समतापी है अतः सम्पूर्ण ऊष्मा कार्य में परिवर्तित हो जाती है अर्थात ऊर्जा परिवर्तन शून्य है (E = 0) | यदि किया गया कार्य
पद-2 रूद्धोष्म प्रसार (Adiabatic expansion)– द्वितीय पद में गैस का उत्क्रमणीय रूप से रूद्धोष्म अवस्था में आयतन V2 से V3 तक (बिन्दु B से बिन्दु C तक) प्रसार किया जाता है। रूद्धोम अवस्था में q= 0 है । अतः ताप T तक (सिंक का ताप) घटता है। ऊष्मागतिकी के प्रथम नियम के
पद-3 समतापी सम्पीड़न (Isothermal compression) तृतीय पद में गैस का समतापी सम्पीडन आयतन V3 से 4 तक (बिन्दु C से बिन्दु D तक) किया जाता है। चूंकि प्रक्रम उत्क्रमणीय एवं समतापी है, अतः AE = 0 प्रथम नियम के अनुसार
पद- 4 रूद्धोष्म सम्पीडन (Adiabatic compre:sion)– अन्तिम पद में गैस को रूद्धोष्म अवस्था में उत्क्रमणीय रूप से आयतन V4 से आयतन V, (मूल अस्था) तक ( बिन्दु D से बिन्दु A तक) सम्पीडित किया जाता है। इस सम्पीडन में ताप T1 से बढ़कर T2 हो जाता है।
चूंकि q= 0 है अतः प्रथम नियम के अनुसार-
E = w4
समीकरण (4) के अनुरूप ही
उपरोक्त चारों पदों के बाद तंत्र अपनी मूल अवस्था में वापस आ जाता है। इस प्रकार यदि सम्पूर्ण चक्र में किया गया कार्य w हो तो यह कार्य प्रत्येक पद में किये गये कार्य का योग होगा।
अतः W =W1 + W2 + W3 + W4
समीकरण (1), (4), (5) तथा (7) से W1. W2. W3 तथा w4 के मान रखने पर
इस प्रकार समीकरण ( 10 ) तथा ( 11 ) से यह स्पष्ट है कि चक्रीय प्रक्रम में AE = 0 होता है, और q=-w
उच्चताप T2 पर अवशोषित ऊष्मा q2 तथा किये गये शुद्ध कार्य में सम्बन्ध निम्न समीकरणों द्वारा ज्ञात किया जा सकता है।
इससे स्पष्ट है कि उच्चताप पर अवशोषित ऊष्मा का कुछ भाग ही कार्य में परिवर्तित होता है शेष भाग परिपार्श्विक (सिक) जो कि निम्न ताप पर है, को दे दिया जाता है या सिंक में चला जाता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics