ऊष्मा रसायन के नियम , लेवोजिए तथा लारलास का नियम , हैस का नियम , गलन की एंट्रोपी , वाष्पन की एंट्रोपी
1. लेवोजिए तथा लारलास का नियम : एक रासायनिक प्रक्रम में अवशोषित अथवा उत्सर्जित उर्जा का मान विपरीत रासायनिक प्रक्रम में उत्सर्जित अथवा अवशोषित ऊर्जा के मान के बराबर होता है।
यदि किसी अभिक्रिया को विपरीत दिशा में लिखा जाए तो उसके △H के मान का चिन्ह बदल जाता है लेकिन उसके मान में कोई अंतर नही होता है।
△H = 68.3 K.Cal
2. हैस का नियम : कोई भी रासायनिक प्रक्रम दो या दो से अधिक विधियों द्वारा संपन्न हो सकता है परन्तु प्रक्रम में होने वाला ऊष्मा परिवर्तन या एन्थैल्पी परिवर्तन समान होता है।
ऊष्मा परिवर्तन प्रक्रम की प्रारंभिक व अंतिम अवस्था पर निर्भर करता है न की उस पथ पर जिससे प्रक्रम गुजरता है।
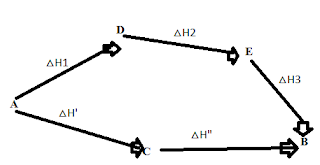
एक सामान्य रासायनिक प्रक्रम A → B में ऊर्जा परिवर्तन का मान △H है , यह प्रक्रम दो अलग अलग पथो द्वारा संपन्न करवाया जाता है।
- पहले पथ के अनुसार A पहले C में तथा फिर B में परिवर्तित होता है तथा इन पथों में अवशोषित ऊष्मा △H’ व △H” है।
- दुसरे पथ के अनुसार A पहले D में फिर D से E में तथा अंत में B में परिवर्तित होता है , इन पथों में अवशोषित ऊष्माये △H1 , △H2 व △H3 है।
हैस के नियमानुसार :-
△H = △H’ + △H” (I पथ)
△H = △H1 + △H2 + △H3 (II पथ)
इस प्रकार प्रक्रम में पूर्ण ऊष्मा परिवर्तन स्थिर रहता है।
स्थिर ताप पर विभिन्न प्रावस्था परिवर्तनों के लिए एंट्रोपी
Tf = ठोस का गलनांक
2. द्रव का वाष्पन (वाष्पन की एंट्रोपी)
एक वायुमण्डलीय दाब पर 1 मोल द्रव पदार्थ को उसके क्वथनांक बिंदु पर द्रव अवस्था से वाष्प अवस्था में परिवर्तन के लिए आवश्यक ऊष्मा की मात्रा को मोलर वाष्पन ऊष्मा कहते है , इसे △Hv से व्यक्त करते है। वाष्पन की प्रक्रिया के दौरान एंट्रोपी में हुए परिवर्तन को मोलर वाष्पन एंट्रोपी कहते है इसे △Sv से व्यक्त करते है।
△Sv = △Hv/Tb
यहाँ
△Sv = मोलर वाष्पन एंट्रोपी
△Hv = मोलर वाष्पन ऊष्मा
Tb = द्रव का क्वथनांक
3. एक क्रिस्टलीय अपरूप का दुसरे क्रिस्टलीय अपरूप में परिवर्तन
एक वायुमण्डलीय दाब पर एक मोल ठोस पदार्थ की एक अपरूपीय अवस्था को संक्रमण ताप पर दूसरी अपरूपीय अवस्था में बदलने के लिए आवश्यक ऊष्मा की मात्रा को मोलर संक्रमण ऊष्मा कहते है , इसे △Ht से व्यक्त करते है।
संक्रमण की प्रक्रिया के दौरान एंट्रोपी में हुए परिवर्तन को मोलर संक्रमण एंट्रोपी कहते है। इसे △St से व्यक्त करते है।
△St = △Ht/Tt
यहाँ
△St = मोलर संक्रमण एंट्रोपी
△Ht = मोलर संक्रमण ऊष्मा
Tt = संक्रमण ताप
tags in English : heat laws chemistry in hindi ?
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics