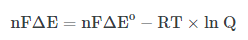गिब्स मुक्त ऊर्जा की परिभाषा क्या है , विद्युत रासायनिक सेल अभिक्रिया की गिब्ज ऊर्जा समीकरण (gibbs energy of a electrochemical cell in hindi)
19 वीं शताब्दी के अंत में जोशिया विलार्ड गिब्स ने एक समीकरण या सूत्र का निर्माण किया जिसके द्वारा किसी रासायनिक समीकरण के लिए मुक्त ऊर्जा का मान ज्ञात किया जा सकता है।
गिब्स मुक्त ऊर्जा समीकरण के अनुसार “किसी भी सेल अभिक्रिया में प्रति सेकंड में किया गया विद्युतीय कार्य का मान , सेल में कुल प्रवाहित आवेश और सेल विभव के गुणनफल के बराबर होता है। ”
गिब्स अनुसार किया सेल द्वारा किया गया कार्य का मान निम्न सूत्र द्वारा दिया जाता है –
W = nFE
यहाँ E = सेल का विभव कहलाता है तथा nF = इलेक्ट्रॉन की संख्या का मान कहलाता है।
किसी रासायनिक समीकरण में गिब्स की मुक्त ऊर्जा में आया परिवर्तन का मान निम्न सूत्र या समीकरण द्वारा ज्ञात किया जाता है –
यहाँ ΔG को किसी रासायनिक अभिक्रिया में गिब्स की मुक्त ऊर्जा में आये परिवर्तन को दर्शाता है , T =परम ताप को प्रदर्शित करता है , R = गैस नियतांक होता ही तथा Q = किसी रासायनिक अभिक्रिया में भाग लेने वाले क्रियाफल की सांद्रता को दर्शाता है अर्थात Q यह बताता है कि क्रियाकारक या क्रियाकारक की सान्द्रता क्या है।
लगभग 20 वीं शताब्दी में जर्मनी के महान रसायन वैज्ञानिक वाल्थर नेर्नस्ट ने गिब्स की इस समीकरण को आगे बढाया , उनके अनुसार किसी विद्युत रासायनिक सेल के लिए गिब्स की मुक्त ऊर्जा में आये परिवर्तन के मान से सेल का विभव ज्ञात किया जा सकता है या सेल विभव को सम्बंधित किया जा सकता है , इसके बाद गिब्स समीकरण निम्न प्राप्त होती है अर्थात नेर्नस्ट के बाद गिब्स समीकरण निम्न प्रकार प्राप्त होती है –
यहाँ n = इलेक्ट्रॉन के मोल है , F को फैराडे नियतांक कहते है , ΔE को सेल का विभव कहा जाता है।
नेर्न्स्ट समीकरण
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics