Extraction of Solute in hindi विलेय का निष्कर्षण क्या है निष्कर्ष प्रक्रिया (Process of Extraction)
जाने Extraction of Solute in hindi विलेय का निष्कर्षण क्या है निष्कर्ष प्रक्रिया (Process of Extraction) ?
वितरण नियम के अनुप्रयोग (Applications of Distribution law)
दो अमिश्रणीय विलायकों में विलेय का वितरण बहुत सी भौतिक तथा रासायनिक समस्याओं को हल करने में बहुत उपयोगी सिद्ध हुआ। जो निम्नानुसार है-
विलेय का निष्कर्षण (Extraction of Solute ) :- निष्कर्षण के प्रक्रम में किसी पदार्थ को विलयन में से अलग करने के लिए विलयन को एक दूसरे अमिश्रणीय विलायक के साथ हिलाया है जिसमें वह पदार्थ अधिक विलेय हो । कार्बनिक पदार्थ जल की अपेक्षा कार्बनिक विलायकों में अधिक विलेयशील होते हैं । अतः कार्बनिक पदार्थों को उनके जलीय विलयन में से उन कार्बनिक विलायकों (जैसे ईथर, CCI4 बेन्जीन, क्लोरोफार्म आदि) के द्वारा निष्कर्षित करते हैं जिनमें वे अधिक विलेयशील होते हैं।
निष्कर्षण के प्रक्रम की कार्यक्षमता निम्न कारकों पर निर्भर करती है-
(i) वितरण का अनुपात – वितरण अनुपात जितना अधिक कार्बनिक विलायक के पक्ष में होगा पदार्थ की उतनी ही अधिक मात्रा एक बार में निष्कर्षित की जा सकेगी।
(ii) निष्कर्षों की संख्या – विलायक की दी हुई मात्रा को अधिक बार प्रयुक्त करके पदार्थ की अधिक मात्रा निष्कर्षित की जा सकती है। निष्कर्ष विलायक का चुनाव इस प्रकार का होना चाहिए कि
(a) यह पूर्व विलायक से पूर्णतया अमिश्रणीय हो
(b) विलेय निष्कर्ष विलायक में अधिक विलेयशील हो
(c) निष्कर्ष विलायक वाष्पशील हो ताकि विलयन को जल ऊष्मक पर गर्म करके विलेय को आसानी से प्राप्त किया जा सके।
निष्कर्ष प्रक्रिया (Process of Extraction) – मान लीजिए कि हमारे पास एक लिटर जलीय विलयन है जिसमें X ग्राम विलेय (कार्बनिक पदार्थ) घुला हुआ है, जिसे हम ईथर के द्वारा निष्कर्षित करना चाहते हैं। कार्बनिक पदार्थ किसी भी विलायक से वियोजन संगुणन अथवा विलायक संकरण नहीं करता है अर्थात् दोनों प्रावस्थाओं में यह समान आणविक अवस्था में रहता है। माना कि इस विलेय का ईथर एवं जल निकाय में वितरण गुणांक 2 है। अर्थात् जल की अपेक्षा यह ईथर में दुगुना अधिक विलेय है। माना ईथर की एक लीटर मात्रा को एक ही बार में निष्कर्षण के लिए प्रयुक्त करने पर ग्राम पदार्थ निष्कर्षित होता है।
अतः ईथर द्वारा 66.7% विलेय निष्कर्षित हो जाता है।
अब मान लीजिए कि हम एक लिटर ईथर को दो बार में 500 मिलि. की किश्तों में प्रयुक्त करते हैं। यदि पहली बार में निष्कर्षित होने वाले पदार्थ की मात्रा w1 है तो
अतः प्रथम निष्कर्षण में जलीय विलयन से ईथर द्वारा विलेय की आधी मात्रा निष्कर्षित हो जायेगी। अब जलीय विलयन में विलेय की शेष मात्रा 0.5X बचेगी। माना दूसरी बार 500 मिली. ईथर प्रयुक्त करने पर w2 ग्राम पदार्थ निष्कर्षित होता है-
अतः 75% विलेय निष्कर्षित हो जाता है।
इसी प्रकार 250-250 मिलि. ईथर की चार किश्तों का उपयोग करके 82.2% और 200-200 मिलि. की पाँच किश्तों का उपयोग से 83.8% पदार्थ निष्कर्षित किया जा सकता है।
अतः उपर्युक्त उदाहरण से स्पष्ट है कि विलायक की दी हुई मात्रा सुविधानुसार अधिक से अधिक किश्तों में प्रयुक्त करना अधिक लाभप्रद है। परन्तु यह स्पष्ट है कि चाहे कितनी ही बार निष्कर्षण करें सम्पूर्ण घुलित पदार्थ अलग करना सम्भव नहीं है क्योंकि हर बार पदार्थ अपने को दोनों विलायकों में वितरित कर लेता है और उसकी कुछ मात्रा भले ही वह कितनी ही कम न हो पूर्व के विलायको में रह जाती है।
विलेय के निष्कर्षण में प्रयुक्त सामान्य सूत्र की व्युत्पत्ति – निश्चित संख्या में निष्कर्षणों के बाद विलयन में रह गये विलेय की अनिष्कर्षित मात्रा (Unextracted amount ) ज्ञात करने के लिये एक सामान्य सूत्र की व्युत्पत्ति करना संभव है। माना कि मिलि. विलयन में विलेय के W ग्राम उपस्थित है। इसका दूसरे विलायकके द्वारा बार-बार निष्कर्षण किया जाता है। एकबार में निष्कर्षण के लिये इ विलायक के v मिलि. प्रयुक्त करते हैं। प्रथम बार में निष्कर्षण करने के पश्चात् विलयन में विलेय के W1 ग्राम अनिष्कर्षित रहते हैं। वितरण गुणांक को निम्न प्रकार लिखा जा सकता है
4.412 विलेयताओं के निर्धारण में (Determination of Solubilities):-दे। अमिश्रणीय विलायकों में किसी विलेय की विलेयताओं का अनुपात वितरण अनुपात के बराबर होता है। यदि दो प्रावस्थाओं में विलेय की सान्द्रताऐं C1 तथा C2 तथा विलेयताएं क्रमशः S1 तथा S2 हो तो
अतः वितरण गुणांक ज्ञात हो तो विलेयताओं को ज्ञात कर सकते हैं।
विलेय का संगुणन :– यदि किसी विलेय के अणु किसी एक विलायक के साथ संगुणित होने वाले अणुओं की संख्या (n) समीकरण ( 27 ) से ज्ञात कर सकते हैं। इससे विलेय का अणुभार ज्ञात कर लेते हैं। इसी प्रकार ग्राफ विधि द्वारा भी विलायक में अणुओं की जटिलता (n) की गणना की जा सकती है जो निम्न प्रकार से है ।
समीकरण (27) से जब विलेय एक परत विलायक से संगुणित होता है तो
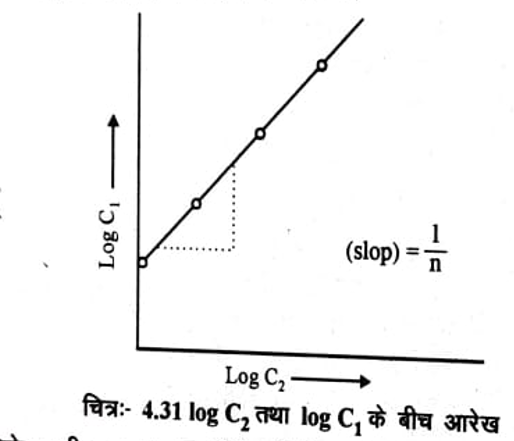
यह एक सीधी रेखा की समीकरण है जिसका ढाल (slope ) 1/ n है। अतः X अक्ष पर log C2 तथा Y- अक्ष पर log C1 के मध्य आलेख खींचने पर चित्र 4.31 के अनुसार एक सीधी रेखा प्राप्त होती है। जिसका ढ़ाल 1 / n है। इससे n का मान ज्ञात कर लेते हैं।
वियोजन की मात्रा (c) जब विलेय किसी एक विलायक में वियोजित होता है तो वियोजन की मात्रा का मान समीकरण (29) द्वारा ज्ञात कर सकते हैं। 4.41.6 वितरण सूचक (Distribution Indicator)- जैसा कि पहले बताया जा चुका है, आयोडीन का जल की तुलना में CS2 या CCI4 में अधिक वितरण होता है। इसलिये जल में बने आयोडीन के अत्यन्त तनु विलयन में CS2 या CCI 4 की कुछ डाल देते हैं जिससे CS2 या CCI4 परत में आयोडीन की सान्द्रता बढ़ जाती है और परत का रंग बैंगनी हो जाता है। इसका अनुमापन सोडियम थायोसल्फेट से किया जा सकता है। अन्तिम बिन्दु पर परत का बैंगनी रंग समाप्त हो जाता है। अतः CS2 या CCI4 परत वितरण सूचक का कार्य करती है।
रजतयुक्त लैड का विरजतीकरण (Desilverisation of Argentiferous lead)– पार्कस प्रक्रम (Parks process) में सीसे से विरजतीकरण के लिये रजत मय सीसे को 800° से तक गर्म करके पिघलाया जाता है। फिर इसमें पिघलता हुआ जस्ता मिला दिया जाता है। इस अवस्था में पिघलता हुआ जस्ता तथा सीसा दो द्रवों की भांति व्यवहार करते हैं तथा रजत विलेय का काम करता है। रजत, जस्त में सीसे से अधिक विलेय होने के कारण जस्त में इसका वितरण गुणांक अनुपात 300: 1 है। इस प्रकार रजत भारी सीसे की परत से जस्त की हल्की परत में आ जाता है तथा ये दोनों पृथक कर लिये जाते हैं। इस प्रक्रम को बार-बार दोहरा कर रजत की लगभग सम्पूर्ण मात्रा का निष्कर्षण किया जा सकता है। विश्लेषिक रसायन में ब्रोमीन तथा आयोडीन का परीक्षण उनके जलीय विलयन से CCI4 द्वारा ब्रोमीन तथा आयोडीन को निष्कर्षित करके किया जाता है।
4.41.8 अवक्षेप को धोना (Washing of Precipitate) – भारात्मक विश्लेषण में अशुद्धियों को दूर करने के लिये अवक्षेप को एक ही बार में सम्पूर्ण धोवन द्रव (Washing liquid) या जल से धोने की अपेक्षा द्रव की थोड़ी-थोड़ी मात्राओं से कई बार धोया जाता है।
4.41.8 संकर यौगिकों का अध्ययन (Study of complex) – इस नियम की सहायता से निम्नलिखित जटिल अभिक्रियाओं का अध्ययन किया जा सकता है।
उदाहरणार्थ- CS2 या CC14 में बने विलयन को KI के जलीय विलयन के साथ हिलाने पर आयोडीन आयोडाइड आयन के साथ जटिल आयन I3 – बनता है।
उचित कार्बनिक विलायक के साथ उपयोग में लाकर वितरण नियम की सहायता से मुक्त ‘आयोडिन अमोनिया तथा ब्रोमीन की सान्द्रताएं निर्धारित कर ली जाती है। इन आंकड़ों द्वारा साम्य स्थिरांक तथा जटिल स्पीशीज के सूत्र निर्धारित किए जा सकते हैं।
लवणों के जल अपघटन की मात्रा (Degree of Hydrolysis of salts) :- वितरण की विधि द्वारा एनिलिन हाइड्रोक्लोराइड का जल अपघटनांक सरलता से ज्ञात किया जा सकता है। :
जल अपघटन स्थिरांक का निर्धारण करने के लिये सर्वप्रथम एक अलग प्रयोग द्वारा ऐनिलीन का बेन्जीन एवं जल में वितरण गुणांक (K) निर्धारित कर लेते हैं। इसमें एनिलीन हाइड्रोक्लोराइड के जलीय विलयन को बेन्जीन के साथ हिलाने पर ऐनिलीन जल एवं बेन्जीन में वितरित हो जाती है जबकि लवण एवं HCl बेन्जीन में अविलेय रहते हैं। माना कि लवण की प्रारम्भिक सान्द्रता x है तथा बेन्जीन परत में ऐनिलीन की सान्द्रता y है और ऐनिलीन का वितरण गुणांक जल तथा बेन्जीन के मध्य K हो तो
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics