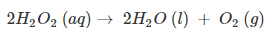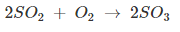डाइऑक्सीजन : O2 बनाने की विधि , ऑक्सीजन के रासायनिक और भौतिक गुण उपयोग (dioxygen in hindi)
डाइऑक्सीजन : यह 16 वर्ग का तत्व है , यह एक अधातु तत्व है और यह बहुत अधिक क्रियाशील होती है। आधुनिक समय में हम जिस आवर्त सारणी का इस्तेमाल करते है उसमें यह तत्व कैल्कोजन ग्रुप का सदस्य होता है। ऑक्सीजन एक द्विपरमाण्विक अणु होता है अर्थात दो ऑक्सीजन तत्व के परमाणु आपस में मिलकर डाइऑक्सीजन का निर्माण करती है , इसका रासायनिक सूत्र O2 होता है , हमारे वातावरण के लगभग 21% भाग में ऑक्सीजन पायी जाती है।
डाइऑक्सीजन बनाने की विधियाँ
- प्रयोगशाला में डाइऑक्सीजन बनाने के लिए ठोस अवस्था में पोटेशियम क्लोरेट का उत्प्रेरकीय क्षय किया जाता है , यहाँ पर मैंगनीज डाइऑक्साइड को उत्प्रेरक के रूप में काम में लिया जाता है , यह क्रिया निम्न प्रकार होती है –
- ऑक्सीजन प्राप्त करने का दूसरा प्रयोगशाला तरीका यह है कि जब धातु ऑक्साइड का ऊष्मा अपघटन किया जाता है तो यह ऑक्सीजन गैस को मुक्त करती है या अभिक्रिया में ऑक्सीजन बनती है जैसे मरकरी ऑक्साइड और सिल्वर ऑक्साइड के ऊष्मा अपघटन से निम्न क्रिया द्वारा ऑक्सीजन बनती है –
- प्रयोगशाला में हम ऑक्सीजन को उच्च ऑक्साइड को उच्च ताप पर तेजी से गर्म करने पर भी निम्न प्रकार प्राप्त कर सकते है , यहाँ मैगनीज और बेरियम आदि उच्च ऑक्साइड है।
डाइऑक्सीजन के रासायनिक और भौतिक गुण
- ऑक्सीजन एक गंधहीन , रंगहीन और स्वादहीन गैस होती है।
- यह वायु से कुछ भारी होती है।
- यह जल में थोड़ी बहुत घुलनशील होती है , अपनी इसी जल में घुलने की प्रवृत्ति के कारण समुद्री जीवों के लिए ऑक्सीजन पानी में उपलब्ध हो पाती है अर्थात जल में रहने वाले जानवर श्वसन आदि के लिए आवश्यक ऑक्सीजन , जल में घुली हुई ऑक्सीजन से प्राप्त करते है।
- जब ऑक्सीजन गैस पर निम्न ताप और उच्च दाब आरोपित किया जाए तो यह गैस से द्रव में बदल जाती है , यह लगभग 90K पर होता है , अगर और भी कम कर दिया जाए अर्थात लगभग 55K पर यह नीले-सफ़ेद ठोस में परिवर्तित हो जाती है।
- यह गैस अनुचुम्बकीय प्रकृति की होती है।
- ऑक्सीजन एक बहुत ही अधिक क्रियाशील अधातुओं में से एक है।
- यह फ़्लोरिन के बाद दूसरा सबसे अधिक विद्युत ऋणात्मक तत्व है।
- डाइऑक्सीजन एक उच्च ऑक्सीकारक होती है , इसको निम्न क्रिया द्वारा समझ सकते है –
- जब डाइऑक्सीजन किसी धातु या अधातु से क्रिया करती है तो क्रिया के फलस्वरूप उस तत्व का ऑक्साइड देती है , निम्न क्रिया द्वारा समझ सकते है –
- लिटमस से क्रिया : डाइ ऑक्सीजन लिटमस के प्रति उदासीन होता है अर्थात यह नीले या लाल रंग के लिटमस के रंग में परिवर्तन नहीं कर सकता है।
- डाइऑक्सीजन दहन में सहायक होती है अर्थात वस्तुओं को जलाने में ऑक्सीजन गैस सहायक होती है लेकिन स्वयं यह गैस दहन नहीं होती है।
डाइऑक्सीजन के उपयोग
- चिकित्सा में मरीजो को कृत्रिम श्वसन के लिए ऑक्सीजन दी जाती है।
- उद्योग क्षेत्र में लोहा अयस्क को स्टील अयस्क में गलाने के लिए इसका उपयोग किया जाता है।
- धातुओं को काटने और वेल्डिंग करने के लिए भी इसका उपयोग होता है।
- अन्तरिक्ष राकेट में द्रव ऑक्सीजन को इंधन के रूप में उपयोग किया जाता है।
- डाइऑक्सीजन , धातुकर्म क्रियाओं में As ,P आदि घुलनशील अशुद्धियो को ओक्सिकृत करने में उपयोगी होता है।
- इसका उपयोग नाइट्रिक अम्ल , एथिलीन ऑक्साइड आदि को बनाने में किया जाता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics