क्रांतिक विलयन ताप किसे कहते हैं संविलयन ताप की परिभाषा क्या है Critical Solution temperature or consolute temp
Critical Solution temperature or consolute temp in hindi क्रांतिक विलयन ताप किसे कहते हैं संविलयन ताप की परिभाषा क्या है क्रांतिक ?
वे द्रव युग्म जिनका क्रान्तिक विलयन ताप निम्न हो (Liquid pairs with lower Critical Solution Temperature)
कुछ ऐसे द्रव युग्म होते हैं, जिनकी पारस्परिक विलेयता (Mutual solubil- ity) ताप बढ़ाने से घटती है।
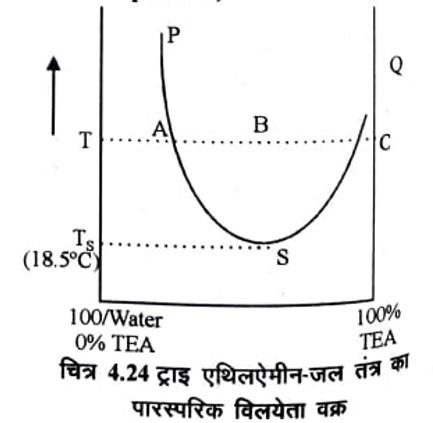
यदि इन द्रवों की पारस्परिक विलेयता को ताप के साथ आरेखित किया जाये तो वक्र की आकृति उल्टी प्राप्त होती है। चित्र 4.24 में ट्राइ – एथिल एमीन (TEA ) जल युग्म तन्त्र की विलेयता दर्शायी गई है।
बिन्दु S क्रान्तिकविलयन बिन्दु है। ताप Tg अथवा इससे नीचे ताप पर जल और TEA का समांगी विलयन प्राप्त होता
है। जैसे ही ताप Ts से अधिक होता है समांगी विलयन दो परतों में पृथक हो जाता है। एक परत TEA का जल में विलयन तथा दूसरी परत जल का TEA में विलयन होती है। यदि ताप T पर इस तंत्र का अध्ययन किया जाता है तो दो परतों का संघटन क्रमश: A तथा B द्वारा दर्शाया जायेगा। AB के मध्य कोई बिन्दु C दोनों परतों की तुलनात्मक मात्रा बताता है। इस द्रव युग्म का Ts = 18.5°C तथा संघटन 50% है। इस प्रकार के अन्य द्रव युग्म निम्न सारणी 4.11 में दर्शाये गये हैं।
वे जिनमें उच्च एवं निम्न दोनों क्रान्तिक विलयन ताप हों द्रव-युग्म (Liquid pairs having upper & lower both critical solution temperature)
कुछ ऐसे द्रव युग्म भी होते हैं, जिनमें उच्च तथा निम्न दोनों ही क्रान्तिक विलयन ताप होते हैं। इन द्रव युग्मों का पारस्परिक विलेयता वक्र चक्रीय (Cyclic) होता है।
चित्र 4.25 में निकोटिन-जल द्रव युग्म की पारस्परिक विलेयता की ताप पर निर्भरता दर्शायी गई है। किसी ताप T पर चक्रीय वक्र के अन्दर किसी बिन्दु C पर दो सतह होंगी, निकोटिन की जल में तथा जल की निकोटिन में। इन सतहों का संघटन क्रमशः A तथा B से सम्बंधित संघटन होता है। चित्र में S उच्च क्रान्तिक विलयन बिन्दु तथा S’ निम्न क्रान्तिक विलयन बिन्दु है। इनसे सम्बंधित ताप Tg = 208°C तथा TS = 60.8°C है। तथा S तथा S’ दोनों ही विलयन का संघटन भार से 32% निकोटिन है। चक्रीय वक्र के बाहर किसी भी ताप पर निकोटिन एवं जल पूर्ण रूप से मिश्रणीय है। इस तंत्र पर दाब के प्रभाव का भी अध्ययन किया गया है। यह पाया गया है कि दाब बढ़ाने से दोनों क्रान्तिक विलयन ताप एक दूसरे की ओर बढ़ते हैं और किसी दाब पर दोनों द्रव पूर्णरूप से मिश्रणीय हो जाते हैं।
इस प्रकार के अन्य द्रव युग्म निम्न सारणी 4.12 में दर्शाये गये हैं।
क्रान्तिक विलयन ताप या संविलयन ताप पर अशुद्धियों का प्रभाव (Effect of foreign Substances on Critical Solution temperature or consolute temp) किसी तंत्र के लिए क्रान्तिक विलयन या संविलन ताप एक निश्चित मान रखता है। किसी भी घटक या दोनों में अशुद्धि मिली होने पर इसका मान बहुत अधिक परिवर्तित हो जाता है।
सर्वप्रथम क्रिसमर ने घुली हुई अशुद्धियों का क्रान्तिक विलयन ताप पर असर का पता लगाया व बताया कि एथेनाल – पेट्रोलियम तंत्र में केवल 1% जल एथेनोल में होने से उसके क्रान्तिक विलयन ताप में 17°C की वृद्धि हो जाती है। यह देखा गया कि दो घटकों में से किसी एक घटक में अशुद्धि घुलनशील हो तो उस तंत्र का क्रान्तिक विलयन या संविलयन ताप बढ़ जाता है।
उदाहरणार्थ- फीनोल- जल तंत्र में 0.1M नेपथेलीन एक प्रतिशत मिलाने पर क्रान्तिक विलयन ताप 20°C बढ़ जाता है। (65°C से 85°C) यह ताप में बढ़ोतरी जल से लवण निकालने के कारण होती है ।
इसी प्रकार अशुद्धि या मिलाया हुआ पदार्थ तंत्र के दोनों घटकों में घुलनशील हो तो उस तंत्र का क्रांन्तिक विलयन ताप का मान कम हो जाता है।
उदाहरणार्थ- फीनोल- जल तंत्र में सक्सिनिक अम्ल मिलाने पर उसका क्रान्तिक विलयन ताप कम हो जाता है। इसको ऋणात्मक लवण निकालना प्रभाव (Negative salting out effect) कहते हैं।
यह देखा गया कि क्रान्तिक विलयन ताप में परिवर्तन अशुद्धि की मात्रा के मिलाने के समानुपाती होता है।
बहुत थोड़ी सी अशुद्धि मिली होने पर क्रान्तिक विलयन ताप में जितना परिवर्तन होता है उससे किसी पदार्थ की शुद्धता की जांच की जा सकती है।
मानव शरीर में गुर्दे द्वारा जो यूरीन निकलता है वह यूरीन फिनोल तंत्र के क्रा. वि. ताप को 8°C बढ़ा देता है। अगर की सही कार्य प्रणाली का पता क्रान्तिक विलयन ताप द्वारा लगा सकते हैं। क्रा.वि.ताप 1 से 16°C तक बढ़ता है तो गुर्दे की कार्य प्रणाली ठीक है ।
अमिश्रणीय द्रव (Immiscible Liquids)
अमिश्रणीय द्रव तंत्र CS2 – जल, CCI4 – जल, जल – Hg आदि में प्रत्येक द्रव (घटक) स्वतंत्र रूप से व्यवहार करता है व एक दूसरे के गुणों पर कोई प्रभाव नहीं डालता है। अर्थात् अमिश्रणीय द्रवों के मिश्रण में प्रत्येक घटक अन्य घटकों से अप्रभावित रूप में अपना वाष्प दाब डालता है और इस प्रकार मिश्रण का कुल (समग्र) वाष्पदाब उस ताप पर समस्त द्रवों के अलग-अलग वाष्प दाबों के योग के बराबर होता है।
माना कि अमिश्रणीय द्रव Aव B है जिनके वाष्प दाब क्रमशः PA व PB है | अतः डाल्टन के आंशिक दाब के नियमानुसार
P = PA + PB ……..(20)
दो अमिश्रणीय द्रव उस ताप पर उबलते है जिस ताप पर दोनों द्रवों का संयुक्त (कुल) वाष्पदाब वायुमण्डलीय दाब के बराबर हो जाता है। अर्थात् PA + PB = वायुमण्डलीय दाब स्पष्ट है कि किसी मिश्रण का क्वथन ताप (Boiling temperature) उसमें उपस्थित शुद्ध द्रवों के क्वथन ताप से कम होता है।
गैस नियमों का उपयोग करके आसुत (Distillate) में दो द्रवों की आपेक्षिक मात्राऐं ज्ञात की जा सकती है। माना कि V वाष्प का आयतन हो तो
यहाँ nA nB क्रमशः द्रव Aव द्रव B की वाष्प प्रावस्था में मोलों की संख्या है। लेकिन हम जानते
अतः आसुत में द्रवो का भार उनके वाष्पदाब व अणुभार के अनुपात में होता है।यह सामान्यीकरण भाप आसवन का आधार भूत सिद्धान्त है।
भाप आसवन (Steam Distillation)
इस विधि का उपयोग ऐसे कार्बनिक यौगिकों के शुद्धिकरण में करते हैं जिनके क्वथनांक काफी उच्च होते है या उनके क्वथनांक तक पहुंचने से पहले ही विघटित हो जाते हैं।
ऐसे द्रव जो जल के साथ अमिश्रणीय हो भाप की उपस्थिति में वाष्पित होते हो व क्वथनांक उच्च हो उदाहरणार्थ-
एनीलीन, बेन्जेल्डीहाइड, नाइट्रोबेन्जीन आदि का भाप आसवन विधि द्वारा शुद्धिकरण करते हैं। भाप आसवन के लिए प्रयुक्त होने वाला उपकरण चित्र 4.26 में दिखाया गया है। इसमें धातु के एक डिब्बा D होता है जिसमें जल के उबलते रहने से निरन्तर भाप बनती रहती है। इस भाप को एक बड़े फ्लास्क F जिसमें अशुद्ध कार्बनिक द्रव है में गुजारते हैं। फ्लास्क एक जल संघनित्र C से जुड़ा रहत है जिसके दूसरे सिरे पर एक ग्राही R रहता है। भाप तथा फ्लास्क F में से निकले हुए कार्बनिक द्रव के वाष्प संघनित होकर ग्राही R में एकत्रित हो जाते हैं। जल तथा कार्बनिक द्रव ग्राही R में अलग-अलग परतों में पृथक हो जाते हैं जिन्हें पृथककारी कीप द्वारा आसानी से अलग-अलग कर लेते हैं। इसके बाद कार्बनिक द्रव को शुष्क करके पुनः आसुत कर लिया जाता है।
ऐनीलीन को जल से शुद्धिकरण करने का मिश्रण 98.5°C पर उबलता है जो ऐनीलीन व जल दोन के क्वथनांक से कम है।
वाष्पों के घनत्व उनके अणुभारों के समानुपाती होते हैं अतः आसुत होने वाले द्रवों का अनुपात निम्नलिखित सूत्र द्वारा व्यक्त होता है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics