रासायनिक साम्यावस्था किसे कहते हैं प्रमुख लक्षण chemical equilibrium in hindi definition characteristics
chemical equilibrium in hindi definition characteristics रासायनिक साम्यावस्था किसे कहते हैं प्रमुख लक्षण क्या है परिभाषा लिखिए |
अध्याय रासायनिक साम्य (CHEMICAL EQUILIBRIUM)
रासायनिक अभिक्रियायें (Chemical Reactions)
रासायनिक अभिक्रिया वह प्रक्रिया है जिसमें एक अथवा अधिक अभिकारक क्रिया करके ऐसे उत्पाद बनाते हैं जो अभिकारकों से रासायनिक दृष्टि से विभिन्न होते हैं। रासायनिक अभिक्रियायें प्रमुख रूप से दो प्रकार से सम्पन्न होती है।
अनुत्क्रमणीय अभिक्रियाएँ (Irreversible Reactions)
जब कोई अभिकारक क्रिया करके उत्पाद में परिवर्तित होते हैं लेकिन उत्पाद से वापस अभिकारक प्राप्त नहीं किया जा सके ऐसी अभिक्रिया अनुत्क्रमणीय अभिक्रिया कहलाती है। उदाहरणार्थ- जब बेरियम क्लोराइड और सल्फ्यूरिक अम्ल के विलयन को मिलाया जाता है तो बेरियम सल्फेट अवक्षेपित हो जाता है।
इसी प्रकार पोटैशियम क्लोरेट को गर्म करने पर
पोटैशियम क्लोराइड व आक्सीजन वापस मिलकर पोटैशियम क्लोरेट नहीं बना सकते।
उत्क्रमणीय अभिक्रियाएँ (Reversible Reactions)
कुछ अभिक्रियाओं की शर्तों (Conditions) में परिवर्तन करके उनकी दिशा को विपरीत किया जा सकता है। अर्थात् अभिक्रिया के उत्पाद क्रिया करके वापस अभिकारकों में परिवर्तित हो सकते हैं। इस प्रकार की अभिक्रियायें उत्क्रमणीय अभिक्रियायें (Reverssible Reactions) कहलाती है। उदारहण के लिये A और B क्रिया करके उत्पाद C और D बनाते हैं। C और D क्रिया करके वापस A और B बना सकते हैं अर्थात्
अतः यदि अभिक्रिया अग्र और प्रतीप दोनों दिशाओं में होती है तो वह अभिक्रिया उत्क्रमणीय अभिक्रिया कहलाती है और उसे
A+B = C+D से व्यक्त किया जाता है।
उत्क्रमणीय अभिक्रियाओं के कुछ उदाहरण निम्न है-
उत्क्रमणीय अभिक्रियाओं का महत्वपूर्ण गुण हैं कि ये अभिक्रियायें पूर्णता की ओर अग्रसर नहीं होती। कुछ समय बाद ऐसा आभास होता है कि अभिक्रिया रूक गई है, परन्तु अभिक्रिया रूकती नहीं है अपितु अग्र और प्रतीप अभिक्रिया का वेग समान हो जाता है। यह अवस्था रासायनिक साम्य (Chemical Equlibrium) की अवस्था कहलाती है।
रासायनिक साम्य (Chemical Equlibrium) रासायनिक साम्य की प्रकृति और उसकी परिभाषा को समझाने के लिए हम एक उत्क्रमणीय अभिक्रिया पर विचार करते हैं।
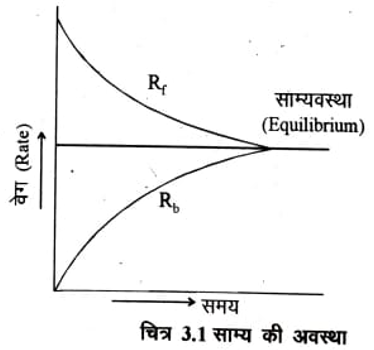
प्रारम्भ में A और B की कुछ मात्रायें एक बंद पात्र में लेते हैं। जैसे ही प्रक्रिया प्रारम्भ होगी C और D का बनना प्रारम्भ हो जायेगा और साथ ही साथ C और D क्रिया करके A और B बनाना प्रारम्भ कर देगें। अर्थात् अग्र और प्रतीप अभिक्रियायें लगभग एक ही समय प्रारम्भ हो जाती है। प्रारम्भ में अग्र अभिक्रिया का वेग प्रतीप अभिक्रिया के वेग से बहुत अधिक होगा। परन्तु जैसे-जैसे C और D की मात्रा बढ़ेगी प्रतीप अभिक्रिया का वेग भी बढेगा। इस प्रकार समय के साथ अग्र अभिक्रिया का वेग घटेगा जबकि प्रतीप अभिक्रिया का वेग बढ़ेगा। कुछ समय पश्चात् ऐसी स्थिति आती है कि अग्र और प्रतीप अभिक्रियाओं के वेग समान हो जाते हैं और अभिक्रिया साम्य की अवस्था में आ जाती है।
उत्क्रमणीय अभिक्रिया की वह स्थिति जबकि दो विपरीत अभिक्रियायें समान वेग से होती हों और अभिकारकों और उत्पादों की सान्द्रता समय के साथ परिवर्तित नहीं हो साम्य की स्थिति या साम्यवस्था कहलाती है। चित्र 3. 1 से साम्यवस्था को समझा जा सकता है।
साम्यवस्था पर यद्यपि अभिकारकों और उत्पादों की सान्द्रता में परिवर्तन नहीं होता परन्तु अग्र और प्रतीप दोनों अभिक्रियायें सम्पन्न होती रहती हैं। अतः रासायनिक साम्य एक गतिज साम्य (Dy- namic Equilibrium) होता है।
रासायनिक साम्य गतिज होता है यह देखने के लिये हम अभिक्रियाकी साम्यवस्था का अध्ययन करते हैं। साम्यवस्था पर उपस्थित H2, I2 तथा HI की सान्द्रतायें स्थिर हो जाती हैं। इस अवस्था में हम थोड़ी सी रेडियों सक्रिय आयोडीन (Radio active Iodine) अभिक्रिया मिश्रण में मिला देते हैं। कुछ समय बाद अभिक्रिया मिश्रण का विश्लेषण करने पर ज्ञात होता है कि HI में भी रेडियों सक्रिय आयोडीन उपस्थित है। इससे यह स्पष्ट है कि साम्य की अवस्था में भी अग्र और प्रतीप अभिक्रियायें सम्पन्न होती रहती हैं.
परन्तु दोनों अभिक्रियाओं के वेग समान रहते हैं।
रासायनिक साम्य के प्रमुख लक्षण (Important characteristics of chemical equilibrium) रासायनिक साम्य के कुछ प्रमुख लक्षण इस प्रकार हैं-
(i) खुले पात्र में साम्य (Equilibrium in open vessel):- गैसीय अभिक्रियाओं में साम्य खुले पात्र में स्थापित नहीं हो सकता। क्योंकि साम्य तब ही स्थापित हो सकता है जबकि अभिकारकों अथवा उत्पादों को बाहर नहीं निकलने दिया जाये। गैसीय अभिक्रियाओं में खुले पात्र में यह संभव नहीं हैं।
यदि अभिकारक अथवा उत्पाद कोई भी बाहर निकलता है तो साम्यवस्था स्थापित नहीं हो सकती। यदि अभिकारक और उत्पाद मिश्रणीय द्रव अवस्था में हो तो खुले पात्र में साम्य स्थापित हो सकता
(ii) अभिकारकों और उत्पादों की स्थिर सान्द्रता (Constant Concentration of Reactants and products) :- एक निश्चित ताप पर साम्यवस्था बंद पात्र में स्थापित होती है साम्य की अवस्था में बचे हुये अभिकारकों एवं बने हुये उत्पादों की सान्द्रतायें स्थिर हो जाती हैं। किसी अभिक्रिया में साम्यवस्था ज्ञात करने में भी इस लक्षण को आधार बनाया जाता है।
माना कि एक बंद पात्र में हाइड्रोजन और आयोडीन लेकर क्रिया कराते हैं। विभिन्न समय अन्तरालों पर बने हुये HI की मात्रा ज्ञात करते हैं। जैसे ही बने हुए HI की सान्द्रता स्थिर हो जाती है, यह मान लिया जाता है कि साम्यवस्था H2 I2 = 2HI स्थापित हो गई हैं।
(iii) साम्यवस्था दोनों और से स्थापित हो सकती है (Equibrium can be Attained from Either Side ) :- किसी भी अभिक्रिया की साम्यवस्था अभिकारक अथवा उत्पाद दोनों में से किसी को भी लेकर प्राप्त की जा सकती है।
उदाहारण के लिये साम्यवस्था
N2(g) + 3H2(g) = 2NH3(g)
को नाइट्रोजन और हाइड्रोजन अथवा अमोनिया दोनों द्वारा प्राप्त किया जा सकता है। माना कि उपरोक्त अभिक्रिया N2 और H2 को 1 : 3 अनुपात में बन्द पात्र में लेकर 573K ताप और 30 वायुमण्डल दाब पर की जाती है। N2 और H2 क्रिया करके NH3 बनाते हैं। साम्यावस्था पर भार से लगभग 7% अमोनिया प्राप्त होती है।
इसके पश्चात एक बन्द पात्र में अमोनिया लेकर 573K ताप तथा 30 वायुमण्डल दाब पर विघटित किया जाता है। साम्यवस्था प्राप्त होने पर भार से लगभग 93% अमोनिया विघटित हो जाती है और लगभग 7% अमोनिया साम्यवस्था पर बची रहती है जो कि पूर्व के समान ही हैं।
(iv) उत्प्रेरक का प्रभाव (Effect of Catalyst) :- साम्यवस्था पर उत्प्रेरक का कोई प्रभाव नहीं होता अर्थात् उत्प्रेरक साम्यवस्था को परिवर्तित नहीं कर सकता क्योंकि उत्प्रेरक द्वारा अग्र और प्रतीप दोनों अभिक्रियायें समान रूप से प्रभावित होती है अर्थात् अग्र और प्रतीप दोनो अभिक्रिया के वेग समान रूप से बढ़ते हैं। चित्र 3.2 में बिन्दुकित रेखा उत्प्रेरक की उपस्थिति और सतत रेखा उत्प्रेरक की अनुपस्थिति में अग्र और प्रतीप अभिक्रिया वेग को दर्शाती है। साम्यवस्था पर अग्र और प्रतीप अभिक्रियाओं के वेग समान हो जाते हैं।
चित्र से स्पष्ट है कि उत्प्रेरक मिलाने पर साम्यवस्था स्थापित होने में समय कम लगता है। अर्थात्
t2 < t1
(v) मुक्त ऊर्जा परिवर्तन और साम्यवस्था (Free Energy Change and Equilibrium):- प्रत्येक अभिक्रिया की साम्यवस्था पर मुक्त ऊर्जा परिवर्तन शून्य होता है अर्थात् G = 0
3.3 द्रव अनुपाती क्रिया नियम (Law of Mass Action) विल्हैल्मी (Wilhelmy 1850) को शर्करा के अम्लीय जल अपघटन के अध्ययन के दौरान पता चला कि जैसे-जैसे शर्करा की सान्द्रता बढ़ाई जाती है, जल अपघटन अभिक्रिया का वेग भी बढ़ता है। इसी प्रकार शर्करा की सान्द्रता घटाने पर अभिक्रिया वेग भी घटता है।
इसी प्रकार बर्थेलोट और से० गिल्स (Berthlot and St. Gilles) ने ऐसिटिक अम्ल के ऐस्टरीकरण का अध्ययन करके पता लगाया कि अभिकारकों की सान्द्रता का प्रभाव बने हुए एस्टर की मात्रा पर पड़ता है।
गुल्डबर्ग और वागे (Guldbeg and Waage) ने इसी प्रकार के अनेक प्रयोग किये। प्रयोगों के निष्कर्ष को उन्होनें द्रव अनुपाती क्रिया नियम (Law of Mass Action) के रूप में व्यक्त किया। एक निश्चित ताप पर किसी पदार्थ के क्रिया करने का वेग उसके सक्रिय द्रव्यमान के समानुपाती है तथा एक समांगी अभिक्रिया का वेग उसमें भाग लेने वाले क्रिया कारकों के सक्रिय द्रव्यमान के गुणनफल के समानुपाती होता है।
माना कि अभिक्रिया A + B उत्पाद है।
इस नियम के अनुसार यदि R अभिक्रिया वेग हो तो
Ra [A] [B]
R =K[A] [B] ……………..(1)
K = अभिक्रिया का वेग स्थिरांक है।
यहां सक्रिय द्रव्यमान (Active mass) का अर्थ मोलर सान्द्रता अथवा सान्द्रता मोल प्रतिलीटर है। इस सूत्र को वर्ग कोष्ठक (Square brackets) [ ] में लिख कर व्यक्त किया जाता है।
[A] = A का सक्रिय द्रव्यमान अथवा A की मोलर सान्द्रता
[B] = B का सक्रिय द्रव्यमान अथवा B की मोलर सान्द्रता
वास्तव में सक्रिय द्रव्यमान का अर्थ प्रभावी सान्द्रता (Effective Concentration) अथवा सक्रियता (Activity) होता है। यदि सान्द्रता को C तथा प्रभावी सान्द्रता को a से प्रदर्शित किया जाये तो दोनों में सम्बन्ध निम्न व्यंजक द्वारा दिया जाता है।
a =fc ……………………(2)
f = सक्रिय गुणांक कहलाता है।
आदर्श परिस्थितियों में का मान इकाई होता है।
अतः a = C
अर्थात् सक्रिय द्रव्यमान = मोलर सान्द्रता ।
यदि अभिक्रिया की समीकरण में पदार्थों के साथ गुणांक हों तो वे सान्द्रता पदों की घात बन जाते
अतः एक सामान्य अभिक्रिया
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics