किरेलता (chirality) किसे कहते हैं असममित कार्बन (asymmetric carbon) , अकिरेल (Achiral) या सममित (symmetric)
किरेलता (chirality) किसे कहते हैं या असममित कार्बन (asymmetric carbon) : यदि किसी कार्बनिक यौगिक में कार्बन से चार भिन्न समूह जुड़े हो तो ऐसे कार्बन को किरेल कार्बन व ऐसे यौगिक को कीरेल यौगिक कहते है।
किरेल यौगिक प्रकाशिक समावयवता दर्शाते है।
कीरेल यौगिको के बने दर्पण प्रतिबिम्ब एक दुसरे पर अध्यारोपित नहीं होते इसलिए यह प्रकाशिक समावयवता दर्शाते है।
प्रश्न : सजीवो में किरेलता के दो उदाहरण दीजिये।
उत्तर : (i) दायें व बाएं हाथ की अंगुलियाँ।
(ii) दाये व बाये पैर की अंगुलियां
प्रश्न : निर्जीवो में किरेलता के उदाहरण दीजिये।
उत्तर : (i) चाय के कप
(ii) हाथो के दस्ताने
(iii) जूते
(iv) जुराब (मौजे)
प्रश्न : अंग्रेजी वर्णमाला के कौनसे शब्द किरेलता दर्शाते है ?
उत्तर : P , q , F आदि।
अकिरेल (Achiral) या सममित (symmetric) : वे कार्बनिक यौगिक जिनमे कार्बन से दो या दो से अधिक समूह समान जुड़े होते है तो ऐसे यौगिक अकीरेल कहलाते है।
इनमे सममित यौगिक भी कहते है।
यह यौगिक ध्रुवण अघुर्णक होते है।
यह प्रकाशिक समावयवता नहीं दर्शाते है।
उदाहरण : प्रोपनोइक अम्ल
प्रश्न : अकिरेल वस्तुओ के उदाहरण दीजिये।
उत्तर : (i) पार्टी ware कप
(ii) शून्य (जीरो) (0)
(iii) त्रिभुज
(iv) अंग्रेजी वर्णमाला अक्षर (H)
दो कीरेल कार्बन युक्त यौगिक (two chiral carbon containing compound) : वे कार्बनिक यौगिक जिनमे दो किरेल कार्बन पाए जाते है , दो किरेल कार्बन युक्त यौगिक कहलाते है।
यह यौगिक ध्रुवण घुर्णक व अघूर्णक दोनों प्रकार के हो सकते है।
यह यौगिक प्रकाशिक समावयवता प्रदर्शित कर भी सकते है और नहीं भी।
उदाहरण : 2 , 3-di chloro butane
नोट : दो किरेल कार्बन युक्त यौगिक में सममित के तत्व उपस्थित हो तो ऐसे यौगिक ध्रुवण अघूर्णक होते है व प्रकाशिक समावयवता नही दर्शाते है।
सममित के तत्व : यदि किसी यौगिक में सममित के तत्व पाए जाते है ऐसे यौगिक धुर्वण अधुर्णक हो व प्रकाशिक समावयवता नहीं दर्शाते है।
यह सममिति के तत्व निम्न है –
(a) सममित-तल (plane of symmetry)
(b) सममिति-अक्ष (axis of symmetry)
(c) सममिति-केन्द्र (centre of symmetry)
(a) सममित-तल (plane of symmetry) : किसी कार्बनिक यौगिक में पाया जाने वाला तल जो उसे दो बराबर भागो में बांटा है तथा दोनों भाग आपस में एक-दूसरे के प्रतिबिम्ब समावयवता होते है , तो इसे सममिति तल तल कहते है।
ऐसे यौगिक धुर्वण अघूर्णक होते है व प्रकाशिक समावयवता प्रदर्शित नहीं करते है।
(b) सममिति-अक्ष (axis of symmetry) : कार्बनिक व यौगिक जिनमे पाया जाने वाला वह अक्ष जिसके सापेक्ष यौगिक को घुमाने पर वह अपनी संरचना प्राप्त कर लेता है तो इसे सममिती अक्ष कहते है।
यह यौगिक ध्रुवण अघूर्णक होते है।
यह यौगिक प्रकाशिक समावयवता नहीं दर्शाते है।
इन यौगिको में घूर्णन अक्ष का मान 360 डिग्री से कम होता है।
इन यौगिको में घूर्णण अक्ष का मान 360/n से प्राप्त किया जाता है।
इसमें n = घूर्णन अक्षो की संख्या है।
उदाहरण : H2O को 180 डिग्री पर घुमाने से यह अपनी पूर्णत: स्थिति में आ जाता है इसलिए इसमें C2 अक्ष पाया जाता है।
(c) सममिति-केन्द्र (centre of symmetry) : कार्बनिक यौगिको में पाया जाने वाला वह केन्द्र जिसमे ऊपर व नीचे जाने पर समान समूह प्राप्त होते है तो इसे सममिति केन्द्र कहते है।
यह घूर्णक घूर्णकता नहीं दर्शाते है। यह प्रकाशिक समावयवता नहीं दर्शाते है।
प्रश्न 1 : प्रतिबिम्ब समावयवता किसे कहते है ? समझाइये।
उत्तर : वे कार्बनिक यौगिक जिनमे किरेल कार्बन पाया जाता है तथा जिनके बने दर्पण प्रतिबिम्ब एक दूसरे पर अध्यारोपित नहीं होते है तो इन्हें प्रतिबिम्ब समावयवी कहते है तथा इस घटना को प्रतिबिम्ब समावयवता के नाम से जानते है।
यह यौगिक ध्रुवण घूर्णकता दर्शाते है।
यह यौगिक प्रकाशिक समावयवता दर्शाते है।
नोट : प्रतिबिम्ब समावयवों के भौतिक गुण , रासायनिक गुण व ध्रुवण घूर्णकता के मान समान होते है परन्तु ध्रुवण घुर्णन कोण व ध्रुवण घूर्णन अभिकारक के मान अलग-अलग पाए जाते है।
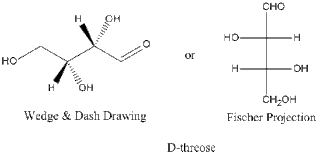
ऐमिल फिशर प्रसेपण सूत्र (emil fischer projection formula) : किसी कार्बनिक यौगिक की 3D संरचना का , 2D संरचना के रूप में कागज या ब्लैकबोर्ड पर सर्वप्रथम फिशर द्वारा समझाया गया।
यह पद्धति सर्वप्रथम फिशर द्वारा 1891 में दी गयी।
इस पद्धति में दो लाइनों को एक दुसरे से उर्ध्वधर व क्षैतिज रूप में काटा जाता है।
जिस स्थान से दोनों लाइनों काटती है उसे किरेल कार्बन के रूप में दर्शाते है।
इसमें क्षैतिज रेखा से जुड़े दोनों समूह तल से ऊपर या हमारी दृष्टा की ओर होता है।
इसमें उर्ध्वाधर रेखा तल के नीचे की ओर होती है जो हमारी दृष्टा से दूर होती है।
इसमें मुख्य क्रियात्मक समूह या कार्बन को उर्ध्वाधर रेखा के ऊपर रेखा जाता है व अंतिम कार्बन को उर्ध्वाधर रेखा के नीचे रखा जाता है।
कीरेल कार्बन से जुड़े दोनों समूहों को क्षैतिज रेखा पर रखा जाता है।
उदाहरण : 2-butanol
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics