आरेनियस समीकरण (arrhenius equation in hindi) , संक्रमण अवस्था (transition state in hindi)
संक्रमण अवस्था (transition state) : किसी रासायनिक अभिक्रिया में अभिकारक अणुओं को उत्पाद में बदलने के लिए एक ऊर्जा अवरोध पार करना पड़ता है।
इसे निम्न उदाहरण द्वारा समझ सकते है –

(अभिकारक) AB + C → [A—–B—–C] → A + BC (उत्पाद)
इस वक्र से स्पष्ट है कि अभिकारक अणु सक्रियण ऊर्जा प्राप्त करके एक उच्च ऊर्जा वाली अस्थायी अवस्था बनाते है , इसे ही संक्रमण अवस्था कहते है।
यह संक्रमण अवस्था तुरंत टूटकर उत्पाद का निर्माण कर लेती है।
ऊष्माक्षेपी व ऊष्माशोषी अभिक्रियाओ के लिए वक्र :-
ऊष्मा क्षेपी के लिए –

ऊष्मा शोषी के लिए –

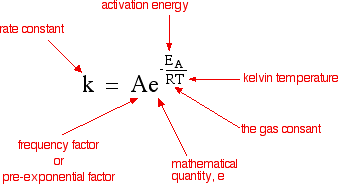
आरेनियस समीकरण (arrhenius equation in hindi) : आर्रेनियस नामक वैज्ञानिक ने सक्रियण ऊर्जा (Ea) व परम ताप T को वेग स्थिरांक K से सम्बन्धित करते हुए एक समीकरण दिया जो निम्न प्रकार है –
K = Ae-Ea/RT (समीकरण-1)
यहाँ K = वेग स्थिरांक
A = आर्रेनियस गुणांक
Ea = सक्रियण ऊर्जा
T = परम ताप
R = गैस स्थिरांक
समीकरण-1 आर्रेनियस समीकरण है।
समीकरण-1 को लघुगुणक के रूप में लिखने पर –
ln K = ln A – Ea/RT
इस समीकरण को log10 में परिवर्तित करने पर , (ln = 2.303 log)
2.303 log K = 2.303 log A – Ea/RT
इस समीकरण में 2.303 से भाग देने पर –
log K = log A – Ea/2.303RT (समीकरण-2)
समीकरण-2 Log के रूप में आर्रेनियस समीकरण है।
आरेनियस समीकरण से सक्रियण ऊर्जा (Ea) की गणना : इस समीकरण से सक्रियण ऊर्जा (Ea) की गणना दो प्रकार से कर सकते है।
- आरेखी विधि
- अन्तराल समीकरण से
- आरेखी विधि: इस विधि से log K व 1/t के मध्य वक्र द्वारा Ea ज्ञात कर सकते है।
समीकरण 2 से –
log K = -Ea/2.303RT + Log A (समीकरण-3)
समीकरण-3 की तुलना सरल रेखा समीकरण y = mx + c से करने पर –
y अक्ष पर = log K
x अक्ष पर = 1/T
ढाल = -Ea/2.303R
अन्त: खण्ड = log A
log K व 1/T के मध्य वक्र खीचने पर ये सरल रेखा के रूप में प्राप्त होता है –

ढाल = -Ea/2.303R
Ea = -2.303R x ढाल
इस सूत्र से सक्रियण ऊर्जा ज्ञात कर सकते है।
- अन्तराल समीकरण से: माना T1 व T2 ताप पर अभिक्रिया के वेग स्थिरांक क्रमशः K1 व K2 हो तो समीकरण 2 से –
Log K1 = – Ea/2.303RT1 + Log A (समीकरण-1)
Log K2 = -Ea/2.303RT2 + Log A (समीकरण-2)
समीकरण (2) में से समीकरण-1 घटाने पर और हल करने पर –
Ea = (log K2 – log K1)2.303RT1T2/(T2-T1) (समीकरण-3)
समीकरण-3 से सक्रियण ऊर्जा (Ea) ज्ञात कर सकते है।
प्रश्न 1 : निम्नलिखित वेग समीकरण के आधार पर अभिक्रिया वेग व वेग स्थिरांक की इकाई लिखिए।
यदि दाब को बार (bar) व समय को मिनट (minute) में मापा जाए तो
अभिक्रिया वेग = K (PCH3OCH3)3/2
उत्तर : अभिक्रिया वेग की इकाई = Bar min-1
अभिक्रिया वेग स्थिरांक K की इकाई = bar min-1/bar3/2
K = bar-1/2 min-1
प्रश्न 2 : परम ताप 298k में 10k की वृद्धि होने पर रासायनिक अभिक्रिया का वेग दुगुना हो जाता है। इस अभिक्रिया के लिए सक्रियण ऊर्जा की गणना कीजिये।
उत्तर : T1 = 298 k
T2 = 298 + 10 = 308 k
Ea = ?
R = 8.314 JK-1mol-1
K2/K1 = 2
Ea = (log K2 – log K1)2.303RT1T2/(T2-T1)
मान रखकर हल करने पर –
Ea = 52897 J/mol
प्रश्न 3 : हाइड्रो कार्बन का विघटन निम्न समीकरण के अनुसार होता है। Ea की गणना कीजिये।
K = (4.5 x 1011 S-1)e-28000/T
उत्तर : इस समीकरण की तुलना आरेनियस समीकरण K = Ae-Ea/RT से करने पर –
Ea/RT = 28000/T
Ea = 28000R
R = 8.314 JK-1mol-1
Ea = 232792 j/mol
प्रश्न 4 : H2O2 के प्रथम कोटि के विघटन को निम्न समीकरण द्वारा लिख सकते है –
Log K = 14.34 – 1.25 x 104 K/T
इस अभिक्रिया के लिए Ea की गणना कीजिये। कितने ताप पर इस अभिक्रिया की अर्द्धआयु 256 मिनट होगी ?
उत्तर : Log K = 14.34 – 1.25 x 104 K/T
समीकरण की तुलना आरेनियस की log समीकरण log K = log A – Ea/2.303RT से करने पर –
Ea/2.303RT = 1.25 x 104 K/T
Ea = 23.93 x 10-4 जूल/मोल
T ज्ञात करना है –
T1/2 = 256 मिनट = 15360 सेकंड
K1 = 0.693/t1/2
K1 = 45 x 10-6 sec-1
K1 का मान उपरोक्त समीकरण log K = log A – Ea/2.303RT में रखने पर और हल करने पर –
T = 669 K