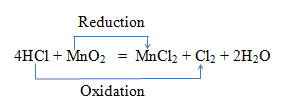ऑक्सीकरण अंक (oxidation number in hindi) , ऑक्सीकरण अंक निकालने के लिए नियम , अनुप्रयोग
(oxidation number in hindi) ऑक्सीकरण अंक : किसी भी यौगिक अथवा तत्व के अणु में उपस्थित किसी परमाणु पर उपस्थित आवेश के मान को उस परमाणु का ऑक्सीकरण अंक कहा जाता है , परमाणु पर यह आवेश का मान इलेक्ट्रॉन के स्थानांतरण के कारण उत्पन्न होता है।
ऑक्सीकरण अंक निकालने के लिए स्वेच्छ नियम
1. मुक्त अवस्था में तत्व का ऑक्सीकरण अंक शून्य होता है।
उदाहरण : Na , K , Cl2 , S8 , P4 , I2 , H2
, O2 आदि में परमाणु का ऑक्सीकरण अंक शून्य होता है।
2. किसी भी अपरूप में तत्व के प्रत्येक परमाणु का ऑक्सीकरण अंक शून्य होता है।
उदाहरण : हीरे में कार्बन परमाणु , S8 में सल्फर परमाणु का ऑक्सीकरण अंक शून्य होता है।
3. क्षारीय धातुओं का ऑक्सीकरण अंक +1 होता है तथा क्षारीय मृदा धातुओं का ऑक्सीकरण अंक +2 होता है। 4. किसी एक परमाण्विक आयन का ऑक्सीकरण अंक उस पर उपस्थित आवेश की संख्या के बराबर होता है।
जैसे : Cl– , mg2+ , S2- , Al3+ , Na+ आयनों का ऑक्सीकरण अंकक्रमशः -1 , +2 , -2 , +3 , +1 होता है।
5. प्रत्येक यौगिक का ऑक्सीकरण अंक शून्य होता है तथा अणु में बीज गणितीय योग शून्य होता है।
उदाहरण : एक यौगिक का अणुसूत्र AxBy है ,
[X x A तत्व का ऑक्सीकरण अंक ] + [Y x B तत्व का ऑक्सीकरण] = 0
6. बहुपरमाणुक आयन में उपस्थित तत्वों के ऑक्सीकरण अंक का बिजगणितीय योग उस आयन पर उपस्थित आवेश के बराबर होता है।
उदाहरण : एक आयन का अणुसूत्र ABYn- है
[A तत्व का ऑक्सीकरण अंक] + [Y x B तत्व का ऑक्सीकरण अंक] = -n
उदाहरण : [PtCl6]2- में Pt का ऑक्सीकरण अंक ज्ञात कीजिये –
x + (-6) = -2
x – 6 = -2
x = +4
7. सामान्यतया H परमाणु का ऑक्सीकरण अंक +1 होता है।
अपवाद : हाइड्राइडो में H परमाणु का ऑक्सीकरण अंक -1 होता है।
उदाहरण : NaH , LiH , MgH2 , CaH2 आदि में H का ऑक्सीकरण अंक -1 होता है।
8. सामान्यतया यौगिको में O2 का ऑक्सीकरण अंक -2 होता है।
अपवाद 1 : परॉक्साइड में O2 का ऑक्सीकरण अंक -1 होता है।
अपवाद 2 : OF2 में O2 का ऑक्सीकरण अंक +2 होता है।
अपवाद 3 : O2F2 में O2 का ऑक्सीकरण अंक +1 होता है।
9. समस्त यौगिकों में हैलोजन का ऑक्सीकरण अंक -1 होता है।
अपवाद : जिन यौगिको में तत्व (Cu , Br , I) , F व O से जुड़े होते है तो इन तत्वों का ऑक्सीकरण अंक +1 होता है।
10. किसी तत्व का ऑक्सीकरण अंक n से लेकर (n – 8) के मध्य होता है।
जहाँ : n = संयोजकता (बाह्यतम कोश में इलेक्ट्रॉन की संख्या)
उदाहरण : नाइट्रोजन (N) का ऑक्सीकरण अन्क +5 से लेकर -3 के मध्य होता है।
11. ध्रुवीय सहसंयोजक यौगिक में साझे का इलेक्ट्रॉन उस परमाणु के पास माना जाता है जिसकी विद्युत ऋणता अधिक होती है।
उदाहरण : HCl में H का ऑक्सीकरण अंक +1 तथा Cl का ऑक्सीकरण अंक -1 होता है।
12. उपसहसंयोजक यौगिकों में दाता परमाणु का ऑक्सीकरण अंक +2 तथा ग्राही परमाणु का ऑक्सीकरण अंक -2 होता है।
13. किसी अधातु तत्व के धातु अथवा H के साथ बने यौगिक में अधातु तत्व का ऑक्सीकरण ऋणात्मक होता है जबकि धातु तत्व का ऑक्सीकरण अंक धनात्मक होता है।
14. संकर यौगिको में प्रत्येक तत्व के ऑक्सीकरण अंक का मान लगाने की अपेक्षा समूह अथवा मूलको का ऑक्सीकरण अंक लगाना अधिक सुविधाजनक रहता है।
, O2 आदि में परमाणु का ऑक्सीकरण अंक शून्य होता है।
2. किसी भी अपरूप में तत्व के प्रत्येक परमाणु का ऑक्सीकरण अंक शून्य होता है।
उदाहरण : हीरे में कार्बन परमाणु , S8 में सल्फर परमाणु का ऑक्सीकरण अंक शून्य होता है।
3. क्षारीय धातुओं का ऑक्सीकरण अंक +1 होता है तथा क्षारीय मृदा धातुओं का ऑक्सीकरण अंक +2 होता है। 4. किसी एक परमाण्विक आयन का ऑक्सीकरण अंक उस पर उपस्थित आवेश की संख्या के बराबर होता है।
जैसे : Cl– , mg2+ , S2- , Al3+ , Na+ आयनों का ऑक्सीकरण अंकक्रमशः -1 , +2 , -2 , +3 , +1 होता है।
5. प्रत्येक यौगिक का ऑक्सीकरण अंक शून्य होता है तथा अणु में बीज गणितीय योग शून्य होता है।
उदाहरण : एक यौगिक का अणुसूत्र AxBy है ,
[X x A तत्व का ऑक्सीकरण अंक ] + [Y x B तत्व का ऑक्सीकरण] = 0
6. बहुपरमाणुक आयन में उपस्थित तत्वों के ऑक्सीकरण अंक का बिजगणितीय योग उस आयन पर उपस्थित आवेश के बराबर होता है।
उदाहरण : एक आयन का अणुसूत्र ABYn- है
[A तत्व का ऑक्सीकरण अंक] + [Y x B तत्व का ऑक्सीकरण अंक] = -n
उदाहरण : [PtCl6]2- में Pt का ऑक्सीकरण अंक ज्ञात कीजिये –
x + (-6) = -2
x – 6 = -2
x = +4
7. सामान्यतया H परमाणु का ऑक्सीकरण अंक +1 होता है।
अपवाद : हाइड्राइडो में H परमाणु का ऑक्सीकरण अंक -1 होता है।
उदाहरण : NaH , LiH , MgH2 , CaH2 आदि में H का ऑक्सीकरण अंक -1 होता है।
8. सामान्यतया यौगिको में O2 का ऑक्सीकरण अंक -2 होता है।
अपवाद 1 : परॉक्साइड में O2 का ऑक्सीकरण अंक -1 होता है।
अपवाद 2 : OF2 में O2 का ऑक्सीकरण अंक +2 होता है।
अपवाद 3 : O2F2 में O2 का ऑक्सीकरण अंक +1 होता है।
9. समस्त यौगिकों में हैलोजन का ऑक्सीकरण अंक -1 होता है।
अपवाद : जिन यौगिको में तत्व (Cu , Br , I) , F व O से जुड़े होते है तो इन तत्वों का ऑक्सीकरण अंक +1 होता है।
10. किसी तत्व का ऑक्सीकरण अंक n से लेकर (n – 8) के मध्य होता है।
जहाँ : n = संयोजकता (बाह्यतम कोश में इलेक्ट्रॉन की संख्या)
उदाहरण : नाइट्रोजन (N) का ऑक्सीकरण अन्क +5 से लेकर -3 के मध्य होता है।
11. ध्रुवीय सहसंयोजक यौगिक में साझे का इलेक्ट्रॉन उस परमाणु के पास माना जाता है जिसकी विद्युत ऋणता अधिक होती है।
उदाहरण : HCl में H का ऑक्सीकरण अंक +1 तथा Cl का ऑक्सीकरण अंक -1 होता है।
12. उपसहसंयोजक यौगिकों में दाता परमाणु का ऑक्सीकरण अंक +2 तथा ग्राही परमाणु का ऑक्सीकरण अंक -2 होता है।
13. किसी अधातु तत्व के धातु अथवा H के साथ बने यौगिक में अधातु तत्व का ऑक्सीकरण ऋणात्मक होता है जबकि धातु तत्व का ऑक्सीकरण अंक धनात्मक होता है।
14. संकर यौगिको में प्रत्येक तत्व के ऑक्सीकरण अंक का मान लगाने की अपेक्षा समूह अथवा मूलको का ऑक्सीकरण अंक लगाना अधिक सुविधाजनक रहता है।
ऑक्सीकरण अंको के आधार पर ऑक्सीकरण -अपचयन
ऑक्सीकरण अपचयन अभिक्रियाओं में तत्वों के ऑक्सीकरण अंक भी परिवर्तित हो जाते है।
ऑक्सीकरण : वह रासायनिक परिवर्तन जिसमें तत्व के ऑक्सीकरण अंक में वृद्धि होती है , ऑक्सीकरण कहलाता है।
अपचयन : वह रासायनिक परिवर्तन जिसमें तत्व के ऑक्सीकरण अंक में कमी होती है अपचयन कहलाता है।
नोट : यदि किसी तत्व के ऑक्सीकरण अंक अंक में परिवर्तन नहीं होता है तो उसका न तो ऑक्सीकरण होता है और न ही अपचयन होता है।
अपचायक : जिस पदार्थ का ऑक्सीकरण होता है , वह अपचायक कहलाता है। अत: अपचायक पदार्थ के ऑक्सीकरण अंक में वृद्धि होती है।
ऑक्सीकारक : जिस पदार्थ का अपचयन होता है ,वह ऑक्सीकारक कहलाता है अत: ऑक्सीकारक पदार्थ के ऑक्सीकरण अंक में कमी होती है।
नोट : सम्पूर्ण प्रक्रिया में कुल ऑक्सीकरण अंको में कमी तथा वृद्धि समान होती है।
किसी रासायनिक अभिक्रिया में ऑक्सीकरण अंको के आधार पर ऑक्सीकरण व अपचयन का पता निम्न प्रकार से लगाया जा सकता है –
1. सबसे पहले यौगिक में उपस्थित परमाणुओं के ऑक्सीकरण अंक ज्ञात करते है।
2. अब सभी तत्वों के ऊपर उनके ऑक्सीकरण अंक लिखते है।
3. अब तत्वों के ऑक्सीकरण अंको में परिवर्तन के आधार पर निष्कर्ष निकालते है।
उदाहरण :
उपरोक्त अभिक्रिया में Mn का ऑक्सीकरण अंक +4 से +2 हो रहा है अत: MnO2 का MnCl2 में में अपचयन हो रहा है जबकि Cl का ऑक्सीकरण अंक -1 से 0 हो रहा है अर्थात वृद्धि हो रही है अत: HCl का Cl2 में ऑक्सीकरण हो रहा है।
उपरोक्त अभिक्रिया में MnO2 ऑक्सीकारक व HCl अपचायक है।
ऑक्सीकरण अंक के अनुप्रयोग
1. अम्ल की प्रबलता : अम्ल में केन्द्रीय परमाणु का ऑक्सीकरण अंक बढ़ने पर उसकी प्रबलता भी बढती है अर्थात
अम्ल की प्रबलता ∝ ऑक्सीकरण अंक
2. क्षार की प्रबलता : क्षार में उपस्थित धातु परमाणु का ऑक्सीकरण अंक बढने पर उसकी प्रबलता घटती जाती है।
क्षार की प्रबलता ∝ 1/ऑक्सीकरण अंक
3. ऑक्सीकरण व अपचायक का तुल्यांकी भार : ऑक्सीकरण अंको के मानो के आधार पर ऑक्सीकारक तथा अपचायक पदार्थ का तुल्यांक भार ज्ञात कर सकते है।
ऑक्सीकारक पदार्थ स्वयं इलेक्ट्रॉन ग्रहण करके अपचयित होते है जिससे ऑक्सीकरण अंक के मान में कमी होती है तथा अपचायक पदार्थ इलेक्ट्रॉन त्यागकर ऑक्सीकृत होते है जिससे ऑक्सीकरण अंक के मान में वृद्धि होती है।