समस्थानिक , समभारिक और समन्यूट्रॉनिक क्या है , परिभाषा , तत्व उदाहरण (Isospin , isobars and isotones in hindi)
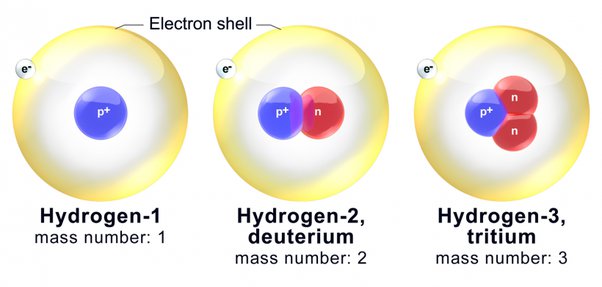
(Isospin , isobars and isotones in hindi) समस्थानिक , समभारिक और समन्यूट्रॉनिक क्या है , परिभाषा , तत्व उदाहरण समस्थानिक किसे कहते है , कितने होते है , संख्या क्या होती है ?:
समभारिक (isobars)
समन्यूट्रॉनिक (isotones)
ऑक्सीजन के तीन समस्थानिक होते हैं – तथा
ओजोनः यह ऑक्सीजन का एक अपररूप है। समुद्र-तट से 30-32 किमी0 की ऊँचाई पर इसकी सान्द्रता अधिक होती है। यह सूर्य से आने वाली पराबैंगनी किरणों के दुष्प्रभाव से बचाती है।
सल्फर
पृथ्वी पटल में सल्फर की प्रतिशतता लगभग 0.05 प्रतिशत है। सल्फर से प्राप्त अत्यधिक महत्त्वपूर्ण औद्योगिक रसायन सल्फ्यूरिक अम्ल है।
सान्द्र सल्फ्यूरिक अम्ल 98 प्रतिशत शुद्ध होता है तथा इसकी नार्मलता 18 होती है।
उपयोगः (प) सल्फ्यूरिक अम्ल का मुख्य भाग उर्वरकों (जैसे-अमोनियम सल्फेट, सुपर फास्फेट आदि) के संश्लेषण में प्रयुक्त होता है। (प) पेट्रोलियम शोधन में (पप) संचालक बैटरी में (पअ) डिटर्जेन्ट उद्योग में (अ) रंजक द्रव्यों, पेण्ट तथा रंगों के संश्लेषण में प्रयुक्त होने वाले मध्यवर्ती यौगिक बनाने में।
नाइट्रोजन
आयतन की दृष्टि से वायुमंडल का 78 प्रतिशत भाग आण्विक नाइट्रोजन है। वायुमंडल सहित पृथ्वी पर नाइट्रोजन का बाहुल्य भारानुसार 0.01 प्रतिशत है।
नाइट्रोजन का उपयोग वहाँ भी करते हैं जहाँ किसी निष्क्रिय गैस की आवश्यकता होती हैय जैसे – लोहा व इस्पात उद्योग में, तनुकारक के रूप में।
द्रव नाइट्रोजन का उपयोग जैव पदार्थों के लिए प्रशीतक के रूप में भोज्य पदार्थों को जमाने एवं निम्न ताप पर शल्य चिकित्सा के लिए होता है।
नाइट्रोजन के यौगिकों में अमोनिया एक प्रमुख यौगिक है। इसका निर्माण हैबर विधि द्वारा किया जाता है।
अमोनिया के उपयोग
(प) बर्फ बनाने में, (पप) नाइट्रिक अम्ल के निर्माण में, (पपप) यूरिया, अमोनिया सल्फेट आदि ऊवर्रक बनाने में, (पअ) सोडियम कार्बोनेट एवं सोडियम बाइकार्बोनेट के निर्माण करने में, (अ) अमोनियम लवण बनाने में, (अप) विस्फोट बनाने में, (अपप) कृत्रिम रेशम बनाने में।
फाॅस्फोरस
फाॅस्फोरस प्राणी तथा वनस्पति पदार्थों का आवश्यक अवयव है। यह हड्डियों तथा जीव-कोशिकाओं (डी.एन.ए. में) में उपस्थित रहता है।
फॉस्फोरस अपररूपता प्रदर्शित करता है। श्वेत फॉस्फोरस एवं काला फॉस्फोरस इसके अपररूप है। लाल फॉस्फोरस, श्वेत फॉस्फोरस की अपेक्षा कम क्रियाशील तथा अम्ल विलेय है।
हैलोजन
वर्ग के तत्त्वों को हैलोजन कहा जाता है।
फ्लोरीन का उपयोगः (प) इसका उपयोग, तथा बनाने में होता है, जिनका क्रमशः परमाणु ऊर्जा उत्पादन तथा परावैद्युतिकी में इस्तेमाल किया जाता है। (पप) के उपयोग द्वारा क्लोरोफ्लोरो कार्बन यौगिक तथा पॉलिटेट्राफ्लुओरो एथिलीन (टेफ्लॉन) संश्लेषित किए जाते हैं। क्लोरोफ्लोरोकार्बन यौगिकों को फ्रियान कहते हैं, इसका उपयोग प्रशीतक के रूप में तथा ऐरोसॉल में किया जाता है।
क्लोरीन का उपयोग अनेक कार्बनिक यौगिकों (जैसे- पॉलिवाइनिल क्लोराइड, क्लोरिनीकृत हाइड्रोकार्बन) औषधियाँ, तथा कीटनाशी के संश्लेषण में किया जाता है। ब्रोमीन का उपयोग एथिलीन ब्रोमाइड के संश्लेषण में होता है, जिसको सीसाकृत पेट्रोल में मिलाया जाता है। इसके अतिरिक्त सिल्वर ब्रोमाइड बनाने में ब्रोमीन इस्तेमाल करते हैं, जिसकी आवश्यकता फोटोग्राफी में होता है।
निष्क्रिय गैस
आवर्त सारणी में शून्य वर्ग में 6 तत्व हैं -हीलियम, निऑन, आर्गन, क्रिप्ट्रॉन, जीनॉन और रेडॉन थे सभी तत्व रासायनिक रूप में निष्क्रिय हैं। अतः इन तत्वों को अक्रिय गैसें या उत्कृष्ट गैसें कहते हैं। रेडॉन को छोड़कर अन्य सभी अक्रिय गैसें वायुमंडल में पायी जाती हैं।
आर्गन का उपयोग मुख्यतः उच्चतापीय धातुकर्मिक प्रक्रियाओं धातुओं अथवा मिश्र धातुओं की आर्क-वेल्डिंग में निष्क्रिय वातावरण उत्पन्न करने तथा बिजली के बल्ब भरने में किया जाता है।
हीलियम हल्की तथा अज्वलनशील गैस है। इसका उपयोगः (प) गुब्बारों को भरने में, (पप) मौसम संबंधी अध्ययनों के लिए (पपप) ठण्डी वायु वाली नाभिकीय भट्टी में (पअ) द्रव हीलियम का उपयोग निम्न ताप पर प्रयोगों में निम्न तापीय अभिकर्मक के रूप करते है।
निऑन का उपयोगः निऑन विसर्जन लैम्पों व ट्यूबों (वायुयान) तथा प्रतिदीप्ति बल्बों में भरी जाती है, जिनकी विज्ञापन के लिए इस्तेमाल करते हैं।
यौगिकों के व्यापारिक एवं रासायनिक नाम
व्यापारिक नाम रासायनि कनाम रासायनिक सूत्र
नमक का अम्लहाइड्रोजन क्लोराइड
शोरापोटेशियम नाइट्रेट
लिथार्जलेड आॅक्साइड
बुझा चूनाकैल्शियम हाइड्राॅक्साइड
लाफिंग गैसनाइट्रस आॅक्साइड
लाल दवापोटैशियम परमैंगनेट
चूनाकैल्शियम आॅक्साइड
लाल सिंदूरलेड पराॅक्साइड
शोरे का अम्लनाइट्रिक अम्ल
लाइम स्टोनकैल्शियम कार्बोनेट
नौसादरअमोनियम क्लोराइड
सिलिकासिलिकाॅन आॅक्साइड
टी.एन.टी.ट्राई नाइट्रो टाॅल्वीन
हृाइट लेडबेसिक लेड कार्बोनेट
मण्डस्टार्च
अंगूर का रसग्लूकोज
सिरकाएसिटिक एसिड का तनु घोल
स्लेटसिलिका, एल्युमिनियम
विरंजक चूर्णकैल्शियम हाइपोक्लोराइड
कास्टिक सोडासोडियम हाइपोक्लोराइड
चाक कैल्शियम कार्बोनेट
सुहागाबोरेक्स
फिटकरीपोटैशियम एल्युमिनियम सल्फेट
गैलेनालेड सल्फाइड
जिप्समकैल्शियम सल्फेट
फाॅर्मलीनफार्मेल्डिहाइड का 23 प्रतिशत विलयन
नीला थोथाकाॅपर सल्फेट
हरा कसीसफेरिक सल्फेट
शुष्क बर्फठोस कार्बन डाईआॅक्साइड
साधारण नमकसोडियम क्लोराइड
कास्टिक पोटाशपोटैशियम हाइड्राॅक्साइड
चिली साल्टपीटर सोडियम नाइट्रेट
कार्बोलिक अम्लफिनोल
स्प्रिटमेथिल एल्कोहाॅल
एल्कोहाॅलएथिल एल्कोहाॅल
खाने का सोडासोडियम बाइकार्बोनेट
धोने का सोडासोडियम कार्बोनेट