Residual Entropy in hindi Statement and Concept अवशिष्ट एन्ट्रोपी का कथन व संकल्पना (धारणा)
अवशिष्ट एन्ट्रापी एंट्रॉपी का कथन व संकल्पना (धारणा) क्या है सूत्र लिखिए Residual Entropy in hindi Statement and Concept ?
अवशिष्ट एन्ट्रोपी का कथन व संकल्पना (धारणा) (Statement and Concept of Residual Entropy)
ऊष्मागतिकी का तृतीय नियम उन पदार्थों के लिए लागू होता है जिनका परम ताप पर पूर्णतया व्यवस्थित विन्यास होता है। एक शुद्ध क्रिस्टल में परमाणु, क्रिस्टल की जालक (Lattice) पर व्यवस्थित रहते हैं। किसी क्रिस्टल के N परमाणुओं को N प्रकार की विभिन्न जालकों में N! प्रकार से व्यवस्थित कर सकते हैं। यह कि शुद्ध क्रिस्टल में सभी परमाणु समान होते हैं व व्यवस्थाएं भी समान है अतः एक दूसरे में विभेद नहीं किया जा सकता। उसके संरूपों (Complexions) की संख्या W को निम्न प्रकार प्रदर्शित करते हैं।
यही ऊष्मागतिकी का तृतीय नियम है। अतः शुद्ध क्रिस्टल की एन्ट्रोपी का मान शून्य होता है।
यदि हमें शुद्ध क्रिस्टल में अलग-अलग प्रकार के a व b परमाणुओं को क्रिस्टल की साइट (Site) पर व्यवस्थित करना हो तो सरूपों की संख्या (Number of complexions) होगी
जहाँ N साइटों की संख्या है जो (Na + Nb) के बराबर है तथा Na व Nb क्रमशः a b परमाणुओं की संख्याएं हैं।
अतः मिश्रित क्रिस्टल की एन्ट्रोपी जिसे अवशिष्ट एन्ट्रोपी ( Residual entropy) कहते हैं जो इस प्रकार है
अगर N का मान बहुत अधिक (Large) है तो समीकरण X का हल स्टर्लिंग सन्निकटन (Stirling approximation)
का उपयोग करने पर समीकरण (137) को इस प्रकार लिखते हैं।
यदि a की मोल भिन्न Xa व B की मोल भिन्न Xb हो तो Na = XaN तथा Nb XbN उस स्थिति में
= Nk (Xa In Xa + Xb In Xb) …(139)
चूंकि किसी भिन्न के लघु गुणक का मान ऋणात्मक होता है अतः कोष्ठक की राशि का मान ऋणात्मक होगा और कोष्ठक के बाहर वैसे ही ऋणात्मक चिन्ह है अतः एन्ट्रोपी का कुल मान धनात्मक हो जाएगा अर्थात् किसी मिश्रित क्रिस्टल की एन्ट्रोपी का मान सदैव धनात्मक होता है और इसे अवशिष्ट एन्ट्रोपी (Residual entropy) के नाम से जानते हैं।
अगर हम यह कल्पना करें कि मिश्रित क्रिस्टल शुद्ध क्रिस्टल a व शुद्ध क्रिस्टल b से बना है तो मिश्रित प्रक्रम के लिए
शुद्ध क्रिस्टल a + शुद्ध क्रिस्टल b मिश्रित क्रिस्टल ab
इस क्रिया में एन्ट्रोपी परिवर्तन का मान
ओर यह एक धनात्मक मात्रा है। अवशिष्ट एन्ट्रोपी के उदाहरण
कई क्रिस्टल ऐसे है जिन पर ऊष्मागतिकी का तृतीय नियम लागू नहीं होता। उदाहरणार्थ- कार्बनमोनोऑक्साइड क्रिस्टल नाइट्रिक ऑक्साइड क्रिस्टल क्रिस्टलीय वर्क आदि। ये पदार्थ रासायनिक दृष्टिकोण से शुद्ध स्तर में है लेकिन परम शून्य ताप पर इनकी एन्ट्रोपी का मान शून्य नहीं है अर्थात् वे पूर्णतया व्यवस्थित विन्यास की शर्तों को पूरा नहीं करते। CO में सही व्यवस्था वह है जिससे सभी कार्बन एक दिशा में होते हैं व सभी ऑक्सीजन दूसरी दिशा
उदाहरणार्थ
वास्तविक क्रिस्टल में अणु के दोनो सिरे अनियमित विन्यासित (Randomly oriented) रहते हैं तथा क्रिस्टल इस तरह व्यवहार करता है कि जैसे यह दो अलग-अलग प्रकार के अणु CO व OC के मिश्रण से बना है। इसका तात्पर्य यह हुआ कि CO क्रिस्टल की अवशिष्ट एन्ट्रोपी होती है। जिसकी गणना समीकरण (141) से ज्ञात कर लेते हैं। अगर उन अणुओं की संख्या ज्ञात हो जाए जो इस प्रकार अलग-अलग विन्यास रखते हैं तो समीकरण (141) से इनकी अवशिष्ट एन्ट्रोपी ज्ञात कर सकते हैं।
इसी प्रकार NO के क्रिस्टलों में भी किनारों पर अणुओं की अव्यवस्था हो जाती है अतः दो प्रकार के विन्यास NO व ON होते हैं। बर्फ में भी परम ताप पर एन्ट्रोपी का मान धनात्मक आता है। इस प्रकार हम देखते हैं कि क्रिस्टलों में अणुओं की थोडी सी अव्यवस्था होने से भी ऊष्मागतिकी के तृतीय नियम का पालन नहीं होता है।
एन्ट्रोपी के निरपेक्ष मानों की गणना (Evaluation of absolute entropy from heat capacity data)
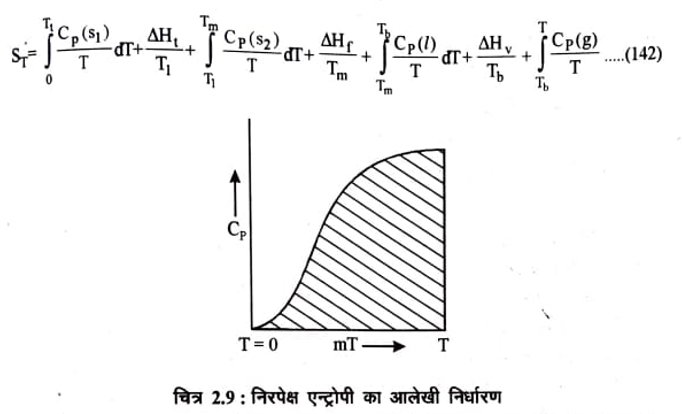
किसी पदार्थ के एक निश्चित ताप पर एन्ट्रोपी के निरपेक्ष मान की गणना समीकरण (110) के आधार पर की जा सकती है। यहाँ यह ध्यान देने योग्य है कि निरपेक्ष मान ज्ञात करने में विभिन्न अवस्था रूपान्तरणों जैसे पिघलना, वाष्पन, संक्रमण आदि के एन्ट्रोपी परिवर्तन को भी सम्मिलित किया जाता है। माना कि एक ठोस को उसके क्वथनांक के उच्च ताप T तक गर्म किया जाता है तो इस ताप पर एन्ट्रोपी निम्नलिखित समीकरण द्वारा व्यक्त की जाती है।
यहाँ Ht Hf Hv क्रमशः संक्रमण, गलन तथा वाष्पन में अवशोषित ऊष्मा है। Tt Tm तथा Tb क्रमशः संक्रमण ताप, गलनांक तथा क्वथनांक है।
S† का यर्थाथ (Accurate) मान ज्ञात करने के लिये यह आवश्यक है कि प्रत्येक अवस्था के लिये Cp का मान सही ज्ञात हो परन्तु Cp का सही मान शून्य परमताप या शून्य परमताप के निकट के ताप पर ज्ञात करना संभव नही है। शून्य परमताप पर Cp का सही मान ज्ञात करने के लिये पहले Cp के मान कुछ उच्च तापों (10K to 15K) पर ज्ञात किये जाते हैं। फिर Cp तथा In Cp/T या T चित्र (2.9) खींच कर बहिर्वेशन (Extraplotation) विधि द्वारा डिवाई “T घन” नियम “T Cube ” (Rule) का उपयोग करते हुये Cp का सही मान ज्ञात किया जाता है।
Cv = aT3
यहाँ a एक स्थिरांक है जो पदार्थ के लक्षणों पर निर्भर करता है। शून्य परमताप के निकट Cp तथा Cv लगभग समान होते हैं। अतः बहिर्वेशन में Cp के स्थान पर Cv का उपयोग किया जा सकता है।
यदि एन्ट्रोपी के मानों की गणना 298K तथा 1 वायुमण्डल दाब पर की जाती हैं तो निरपेक्ष एन्ट्रोपी के ये मान मानक एन्ट्रोपी (Standared Entropy) कहलाते हैं। सारणी 2.2 में कुछ पदार्थों की मानक एन्ट्रोपी के मान दिये गये हैं।
स्वतः प्रवर्तिता एवं साम्यावस्था की सामान्य शर्तें (General Conditions of Spontanity and Equilibrium)
यह विदित है कि उत्क्रमणीय रूपान्तरण में तन्त्र साम्यावस्था से अनन्त सूक्ष्म विस्थापित होता है। यद्यपि रूपान्तरण होता है परन्तु फिर भी तन्त्र लगभग साम्यवस्था में रहता है। इस प्रकार कहा जा सकता है कि यह साम्यवस्था ही उत्क्रमणीयता की शर्त है
यदि किसी प्रक्रम में उत्क्रमणीय रूप से किसी परमताप T पर dqrev ऊष्मा का अवशोषण होता है. तो तन्त्र की एन्ट्रोपी में सूक्ष्म परिवर्तन ds को निम्न प्रकार दिया जा सकता है-
यदि प्रक्रम में रूपान्तरण अनुत्क्रमणीय होता है तो वह स्वतः प्रवर्तित होगा अर्थात् उसकी एक ही दिशा होगी। यह तब ही सम्भव है, जबकि –
……(144)
अतः समीकरण (144) स्वतः प्रवर्तिता की शर्त है।
समीकरण (143) एवं (144) का संयोजन करने पर
यहाँ यह स्पष्ट है कि समानता (=) का चिन्ह ऊष्मा के उत्क्रमणीय अवशोषण (उत्क्रमणीय रूपान्तरण) तथा असमानता (> ) का चिन्ह ऊष्मा के अनुत्क्रमणीय अवशोषण (अनुत्क्रमणीय रूपान्तरण) को प्रदर्शित करता है।
इस प्रकार समीकरण (145) में असमानता स्वतः प्रवर्तिता तथा समानता साम्यावस्था शर्ते हैं। ऊष्मागतिकी के प्रथम नियम के अनुसार-
समीकरण (148) रूपान्तरण की साम्यवस्था (=) तथा स्वतः प्रवर्तिता (>) की शर्ते निर्धारित करती है। यहाँ ds, dE, dV, W क्रमशः रूपान्तरण में होने वाले एन्ट्रोपी परिवर्तन, आन्तरिक ऊर्जा परिवर्तन, आयतन परिवर्तन तथा किये गये कार्य हैं।
तापीय साम्य शर्ते (Conditions of Thermal Equilibium)
किसी तन्त्र की वह अवस्था जबकि तन्त्र के प्रत्येक भाग का ताप समान हो, तन्त्र की तापीय साम्यावस्था कहलाती है। तापीय साम्यवस्था की शर्तें निर्धारित करने के लिए एक विलगित तन्त्र (Isolated System) पर विचार करते हैं।
विलगित तन्त्र वह तन्त्र है जो कि पारिपाश्विक (Surrounding) से ऊर्जा और पदार्थ दोनों का ही आदान-प्रदान नहीं करता । अर्थात् इस तन्त्र द्वारा किया गया कार्य तथा ऊर्जा दोनों ही अपरिवर्तित रहते हैं।
अर्थात् dE = 0
समीकरण (149) से यह स्पष्ट है कि विलगित तन्त्र की एन्ट्रोपी केवल बढ़ती है और साम्यावस्था पर यह अधिकतम हो जाती है।
यह सिद्ध करने के लिये कि, विलगित तन्त्र के प्रत्येक भाग में ताप समान रहता है, इस तन्त्र को दो भागों में विभाजित कर लेते हैं। एक भाग से दूसरे भाग में माना कि qrev ऊष्मा प्रवाहित होती है। यदि dS1 तथा dS2 भाग एक एवं भाग दो में क्रमशः एन्ट्रोपी परिवर्तन तथा T1एवं T2 इन भागों के ताप होतो. समीकरण (143) से
यही तापीय साम्य की शर्त है। अर्थात् यदि कोई तन्त्र तापीय साम्यवस्था में होता है तो प्रत्येक भाग में ताप समान होता है।
हेल्मोट्ज ऊर्जा- स्थिर ताप पर तन्त्र का रूपान्तरण (Transformation of system at constant Temperaure-Helmholt’s Energy)
यदि किसी तन्त्र की अवस्था में स्थिर ताप पर रूपान्तरण किया जाता है तो-
Tds = d(TS) ………………..(154)
अतः समीकरण (147) को निम्न प्रकार से लिखा जा सकता है-
E. T तथा S चरांकों के इस संयोजन (Combination) ” (E- TS)” को एक नये प्रतिक (Symbol) “A” के द्वारा प्रदर्शित किया जाता है।
अतः A =E-TS ….(156)
“A” को तन्त्र की हेल्मोल्ट्स ऊर्जा (Helmholtz energy) कहते हैं। चूंकि चरांक E. T.S आदि अवस्था फलन है, अतः A भी अवस्था फलन (State function) होता है।
समीकरण (155) को इस प्रकार भी लिखा जा सकता है।
– dA > W
समीकरण (157) का समाकलन करने पर –
A >W
A को तन्त्र की हेल्मोल्ट्ज ऊर्जा परिवर्तन कहते हैं।
समीकरण (158) से यह स्पष्ट है कि समतपापी रूपान्तरण में तन्त्र द्वारा किया गया कार्य, हेल्मोल्ट्स ऊर्जा में कमी के बराबर अथवा उससे कम होता है।
हेल्महोल्ज ऊर्जा A की सार्थकता (Significance of Helmholtz Energy A) > यदि A = W है तो यह शर्त तन्त्र की स्वतः प्रवर्तिता दर्शाती है। जबकि A = W की शर्त तन्त्र की साम्यवस्था दर्शाती है। साम्य की अवस्था में ऊष्मा उत्क्रमणीय रूप से प्रवाहित होती है तथा उत्क्रमणीय प्रक्रम में किया गया कार्य अधिकतम होता है। अतः समतापी रूपान्तरण में अधिकतम कार्य होता है, जो कि हेल्मो ऊर्जा में कमी के बराबर होता है। अर्थात् हेल्मोल्ट्ज ऊर्जा में कमी अधिकार कार्य के बराबर होती है। अतः
गिब्ज ऊर्जा (स्थिर ताप व स्थिर दाब पर रूपान्तरण) (Gibbs Eenergy) Transformation at Constant Temperature and at Constant Pressure)
किसी तन्त्र की अवस्था में रूपान्तरण स्थिर ताप व स्थिर दाब पर किया जाता है।
स्थिर ताप पर Tds =d (TS)
तथा स्थिर दाब पर Pav = d(PV)……………(159)
अतः स्थिर दाब एवं स्थिर ताप की अवस्था में समीकरण (148) को निम्न प्रकार से लिखा जा सकता
-dE-d(PV)+d(TS) >0
चूंकि इस अवस्था में तन्त्र में दाब आयतन कार्य के अलावा अन्य कार्य भी होते हैं। अन्य कार्य को से व्यक्त करे तो
चरांकों का यह संयोजन ( E + PV – TS) एक नये प्रतीक “G” द्वारा प्रदर्शित किया जाता है।
अतः
G = E + PV – TS = H – TS = A + PV
“G” को तन्त्र की गिब्ज ऊर्जा (Gibbs Energy) या मुक्त ऊर्जा (Free Energy) कहते हैं। G जिन गुणों का संयोजन है, वे सब ही अवस्था फलन है, अतः G भी अवस्था फलन (State function) होगा।
G का उपयोग करने पर समीकरण (160) या (161) को निम्न प्रकार लिखा जा सकता है-
AG गिब्ज ऊर्जा परिवर्तन कहलाता है।
समीकरण (163) से यह स्पष्ट है कि तन्त्र के स्थिर ताप एवं दाब पर रूपान्तरण में गिब्ज ऊर्जा में कमी, तन्त्र द्वारा – आयतन कार्य के अतिरिक्त किये गये कार्य के बराबर अथवा उससे अधिक होती है।
माना कि – G = wa
चूंकि यह उत्क्रमणीय की शर्त है, अतः इस उत्क्रमणीय रूपान्तरण में गिब्ज ऊर्जा में कमी, स्थिर ताप व दाब पर दाब – आयतन कार्य के अतिरिक्त किये गये अधिकतम कार्य के बराबर होगी।
अनुत्क्रमणीय रूपान्तरण में किया गया अतिरिक्त कार्य गिब्ज ऊर्जा में कमी से कम प्राप्त होगा। माना कि तन्त्र साम्यवस्था में है तथा रूपान्तरण स्वतः होता है। इस रूपान्तरण में दाब – आयतन कार्य के अतिरिक्त कोई अन्य कार्य नहीं होता है अर्थात् = 0 है, तो समीकरण (163) के अनुसार-
साम्यवस्था की स्थिति में समीकरण (164) द्वारा G = 0 एवं स्वतः प्रवर्तिता की स्थिति में – G > 0 होगा।
इस प्रकार हम देखते हैं कि ऊष्मागतिक प्रक्रिया की साम्यवस्था तथा स्वतः प्रवर्तिता निर्धारित करने में गिब्ज ऊर्जा परिवर्तन (G) का बहुत महत्व है।
एक रासायनिक अभिक्रिया के संदर्भ में यदि –
(i) G ऋणात्मक है, (ie G < 0) तो वह अभिक्रिया स्वतः अभिक्रिया होगी अथवा वह परिवर्तन प्राकृतिक होगा।
(ii) G = 0 है तो वह अभिक्रिया साम्यवस्था में होगी या परिवर्तन साम्य में होगा।
(iii) G धनात्मक है, (ie G > 0) तो अभिक्रिया स्वतः प्रवर्तित नहीं होगी अर्थात् प्रक्रम अस्वतः
प्रवर्तित (Nonspontaneus) है। तथा विपरित अभिक्रिया स्वतः अभिक्रिया होगी ।
उपर्युक्त तीनों बिन्दुओं के आधार पर गिब्ज ऊर्जा परिवर्तन को किसी तन्त्र अथवा रासायनिक अभिक्रिया की स्वतः प्रवर्तिता तथा साम्यवस्था के लिए आधार (Crireria) बनाया जा सकता है।
स्वतः अथवा स्वाभाविक रूपान्तरणों के लिये प्रेरक बल (Driving Forces for Natural Changes)
मुक्त ऊर्जा की परिभाषा के अनुसार
इस प्रकार किसी तत्र की गिब्ज ऊर्जा परिवर्तन का मान निर्धारित करने के लिए दो पद है। एक H (पूर्ण ऊष्मा अथवा एन्थैल्पी परिवर्तन) तथा दूसरा S (एन्ट्रोपी परिवर्तन) T S भी एक ऊर्जा पद है जो कि तन्त्र के अणुओं के पुनर्विन्यास (Rearrangement) से सम्बन्धित है और तन्त्र में ही निहित रहता है। इन दोनों पदों का अन्तर G (मुक्त ऊर्जा परिवर्तन) कहलाता है। यह मुक्त ऊर्जा तन्त्र में बाहरी कार्य करने के लिये उपलब्ध रहती है
जैसा कि पूर्व में बताया गया है, स्थिर ताप व दाब पर स्वतः रूपान्तरणों में G का मान ऋणात्मक (G < 0) होता है। अतः तन्त्र की एन्थैल्पी को कम से कम (अर्थात् ऊर्जा कम से कम) तथा एन्ट्रोपी को अधिक से अधिक करने का प्रयास करता है। G का ऋणात्मक मान निम्नलिखित दशाओं में प्राप्त किया जा सकता है-
(i) यदि H का मान ऋणात्मक हो, अर्थात् रूपान्तरण ऊष्माक्षेपी हो तथा S का मान धनात्मक हो ।
(ii) H का मान ऋणात्मक हो तथा रूपान्तरण में S ऋणात्मक हो अर्थात् तन्त्र की एन्ट्रोपी घटे । परन्तु इसके लिये आवश्यक शर्त यह होगी कि TS का धनात्मक मान H के ऋणात्मक मान से कम हो।
(iii) H का मान धनात्मक हो, अर्थात् रूपान्तरण ऊष्माशोषी हो तथा रूपान्तरण में तन्त्र की एन्ट्रोपी में वृद्धि हो अर्थात् S का मान धनात्मक हो। इसके लिये आवश्यक शर्त यह होगी कि TS का ऋणात्मक मान, H के धनात्मक मान से अधिक हो।
अधिकांश स्वतः रासायनिक अभिक्रियायें ऊष्माक्षेपी होती है। इनमें H > TS पाया जाता है। अतः G का मान ऋणात्मक होता है। यहाँ इस बात का ध्यान रखा जाना चाहिये कि G का चिन्ह अभिक्रिया की स्वतः प्रवर्तिता दर्शाता है, G के मान के कम या अधिक होने का स्वतः प्रवर्तिता से कोई सम्बन्ध नहीं है।
G तथा A में सम्बन्ध ( Relation between G and A)
G , A की परिभाषाओं से हम जानते हैं कि-
G=H-TS
A =E-TS
समतापी प्रक्रम में होने वाले परिवर्तन के लिए
यह ठोस तथा द्रवों के लिये आयतन में परिवर्तन V उपेक्षणीय है (V = 0) अतः PV भी उपेक्षणीय होगा अर्थात् PV = 0 अतः
G = A
प्रायः रासायनिक तथा भौतिक अभिक्रियाएं सामान्यतः स्थिर वायुमण्डलीय दाब पर ही होती है। अतः मापन योग्य राशि H का ही सामान्यतः उपयोग किया जाता है। अतः G फलन ही उपयोग करते हैं। न कि A का ।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics