सफ़ेद फास्फोरस से फास्फिन बनाने की प्रयोगशाला विधि , अनुनादी संरचनाएँ , N2O , NO , NO2 ,N2O3
P4 + 3NaOH + 3H2O → (फास्फिन) PH3 + 3NaH2 (सोडियम हाइपो फास्फाइट)
|
नाइट्रोजन के
ऑक्साइड |
N की ऑक्सीजन
अवस्था |
अवस्था एवं
प्रकृति |
|
N2O
|
+1
|
रंगहीन गैस ,
उदासीन |
|
NO
|
+2
|
रंगहीन गैस ,
उदासीन |
|
NO2
|
+4
|
भूरी गैस , अम्लीय
|
|
N2O3
|
+3
|
नीला ठोस , अम्लीय
|
|
N2O4
|
+4
|
रंगहीन ठोस ,
अम्लीय |
|
N2O5
|
+5
|
रंगहीन ठोस , अम्लीय
|
अनुनादी संरचनाएँ :
1. N2O : Dinitrogen oxide / nitrogen (I) oxide
nitrus oxide / laughing gas
2. NO : Nitrogen mono oxide / Nitrogen (II) oxide / Nitric oxide
3. NO2 : Nitrogen di oxide / Nitrogen (IV) oxide
4. N2O3 : dinitrogen tri oxide / nitrogen (III) oxide
5. N2O4 : Di Nitrogen tetra oxide / Nitrogen (IV) oxide
या डाइ नाइट्रोजन टेट्रा ऑक्साइड / नाइट्रोजन (IV) ऑक्साइड
6. N2O5 : Di nitrogen penta oxide / nitrogen (V) oxide
या
डाइ नाइट्रोजन पेंटा ऑक्साइड / नाइट्रोजन (V) ऑक्साइड
P के ऑक्सी अम्लो की संरचना :
1. H3PO2 : हाइपो फास्फोरस अम्ल या hypo phosphorous acid
P की ऑक्सीकरण अवस्था : +1
क्षारकता : 1
2. H3PO3 : ortho phosphorous acid या ऑर्थो फास्फोरस अम्ल
P की ऑक्सीकरण अवस्था : +3
क्षारकता : 2
3. H3PO4 : ऑर्थो फास्फोरिक अम्ल या ortho phosphoric acid
P की ऑक्सीकरण अवस्था : +5
क्षारकता : 3
4. H4P2O5 : पायरो फास्फोरस अम्ल / Pyro phosphorous acid
P की ऑक्सीकरण अवस्था : +3
क्षारकता : 2
5. H4P2O6 : हाइपो फास्फोरिक अम्ल या hypo phosphoric acid
P की ऑक्सीकरण अवस्था : +4
क्षारकता : 4
6. H4P2O7 : पायरो फास्फोरिक अम्ल या pyro phosphoric acid
P की ऑक्सीकरण अवस्था : +5
क्षारकता : 4
7. (HPO3)3 : साइक्लो ट्राई मेटा फोस्फोरिक अम्ल या cyclo tri meta phosphoric acid
P की ऑक्सीकरण अवस्था : +5
क्षारकता : 3
8. (HPO3)n : पोली मेटा फोस्फोरिक अम्ल या poly meta phosphoric acid
P की ऑक्सीकरण अवस्था : +5
क्षारकता : n
P की ऑक्सी अम्लो की संरचना बनाने के नियम निम्न है –
i. P की ओक्सी अम्लो की संरचना में केन्द्रीय P परमाणु के साथ अन्य समूह चतुष्फलकीय रूप में जुड़े होते है।
ii. इन अम्लो की संरचना में कम से कम एक P=O बंध व एक P-OH बन्ध उपस्थित होता है।
iii. इन अम्लो की संरचना में P-P बंध व P-H बन्ध हो भी सकते है और नहीं भी , लेकिन एक संरचना में यह दोनों बन्ध एक साथ कभी भी उपस्थित नहीं होते है।
iv. इन अम्लो में P-OH बंध का -OH समूह प्रोटॉन (H+) त्याग सकता है अत: एक संरचना में -OH समूह की कुल संख्या उस अम्ल की क्षारकता को प्रदर्शित करती है।
v. इनमे +3 ऑक्सीकरण अवस्था वाला अम्ल असमानुपातन दर्शाता है अर्थात इसमें P परमाणु अपनी ऑक्सीकरण अवस्था को घटता भी है और बढ़ता भी है।
उदाहरण : 4H3PO3 → 3H3PO4 + PH3
vi. इन अम्लो में P-H बंध उपस्थित होने पर वह अपचायक के रूप में व्यवहार करता है।
जैसे : H3PO2 में दो P-H बंध उपस्थित होने पर यह प्रबल अपचायक की तरह व्यवहार करता है।
C6H5N2Cl + H2O + H3PO2 → C6H6 + N2 + HCl + H3PO3
सल्फर के ऑक्सी अम्लो की संरचनाएँ :
1. H2SO3 : सल्फ्युरस अम्ल (sulphurus acid)
S की ऑक्सीकरण अवस्था : +4
क्षारकता : 2
2. H2S2O4 : डाइ थायोनस अम्ल / Dithionus acid
S की ऑक्सीकरण अवस्था : +3
क्षारकता : 2
3. H2SO4 : सल्फ्यूरिक अम्ल / sulphuric acid
S की ऑक्सीकरण अवस्था : +6
क्षारकता : 2
4. H2SO5 : peroxo mono sulphuric acid
पेरेक्सो मोनो सल्फ्यूरिक अम्ल
S की ऑक्सीकरण अवस्था : +6
क्षारकता : 2
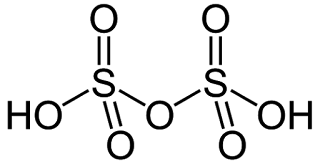
5. H2S2O8 : पेरोक्सो डाइ सल्फ्यूरिक अम्ल या मार्सेल अम्ल या peroxo disulphuric acid or marrshall’s acid
S की ऑक्सीकरण अवस्था : +6
क्षारकता : 2
6. H2S2O7 : पायरो सल्फ्यूरिक अम्ल / डाइ सल्फ्यूरिक अम्ल / ओलियम
या
pyro sulphuric acid / di sulphuric acid / olium
S की ऑक्सीकरण अवस्था : +6
क्षारकता : 2
7. H2S2O6 : Di thionic acid या डाइ थिओनिक अम्ल
S की ऑक्सीकरण अवस्था : +5
क्षारकता : 2
8. H2S3O6 : ट्राई थिओनिक अम्ल या tri thionic acid
S की ऑक्सीकरण अवस्था : +5 , 0
क्षारकता : 2
9. H2S4O6 : टेट्रा थिओनिक अम्ल या tetra thionic acid
S की ऑक्सीकरण अवस्था : +5 , 0
क्षारकता : 2
10. H2S5O6 : पेन्टा थिओनिक अम्ल या penta thionic acid
S की ऑक्सीकरण अवस्था (oxidation state) (O.S) : +5 , 0
क्षारकता : 2
s के ऑक्सी अम्लो की संरचना बनाने के नियम निम्न है –
1. H2SO3
व H2S2O4 को छोड़कर सल्फर के अन्य ऑक्सी अम्लो में केन्द्रीय सल्फर परमाणु के साथ अन्य समूह चतुष्फलकीय रूप में जुड़े होते है।
2. सल्फर के सभी ऑक्सी अम्लो की क्षारकता दो होने के कारण प्रत्येक संरचना में कुल दो -OH समूह उपस्थित होते है।
हैलोजन (X) के ऑक्सी अम्ल : हैलोजन के चार प्रकार के ओक्सी अम्ल होते है।
|
हाइपो हैलस अम्ल
|
HOF
|
HOCl
|
HOBr
|
HOI
|
|
हैलिक (I) अम्ल
(HOX)
|
हाइपो फलोरस अम्ल
|
हाइपो क्लोरस अम्ल
|
हाइपो ब्रोमस अम्ल
|
हाइपो आयोडस अम्ल
|
|
हैलस अम्ल
हैलिक (III) अम्ल
(HOXO)
|
HOF
हाइपो फलोरस अम्ल
|
HOClO
क्लोरस अम्ल
|
HOBr
हाइपो ब्रोमस अम्ल
|
HOI
हाइपो आयोडस अम्ल
|
|
हैलिक अम्ल
हैलिक (IV) अम्ल
|
HOF
हाइपो फलोरस अम्ल
|
HOClO2
क्लोरिक अम्ल
|
HOBrO2
ब्रोमिक acid
|
HOIO2
आयोडिक अम्ल
|
|
पर हैलिक अम्ल
हैलिक (VII) अम्ल
(HOXO3)
|
HOF
हाइपो फलोरस अम्ल
|
HOClO3
परक्लोरिक अम्ल
|
HOBrO3
परब्रोमिक acid
|
HOIO3
परआयोडिक अम्ल
|
क्लोरिन के ऑक्सी अम्लो की संरचना :
1. हाइपोक्लोरस अम्ल / क्लोरिक (I) अम्ल
HOCl / HClO
cl की ऑक्सीकरण अवस्था : +1
2. क्लोरस अम्ल / क्लोरिक (III) अम्ल :
HOClO
/ HClO2
cl की ऑक्सीकरण अवस्था : +3
3. क्लोरिक अम्ल / क्लोरिक (V) अम्ल
HOClO2/HClO3
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics