(fuel cell in hindi) ईंधन सेल किसे कहते है , लाभ , कार्य , उपयोग , फ्यूल सेल इन हिंदी : ऐसी युक्ति जो ईंधन की ऊर्जा को विद्युत ऊर्जा में परिवर्तित कर देती है उसे ईंधन सेल कहते है।
ईंधन से विद्युत
ऊर्जा इसलिए उत्पन्न हो जाती है क्यूँकि यहाँ ईंधन के दहन में रेडोक्स अभिक्रिया होती है जिसके फलस्वरूप ईंधन विद्युत ऊर्जा में परिवर्तित हो जाती है।
अर्थात यह एक ऐसी युक्ति होती है जो रासायनिक
स्थितिज ऊर्जा को विद्युत ऊर्जा में परिवर्तित कर देता है , यहाँ रासायनिक विद्युत ऊर्जा से तात्पर्य है कि अणुओं के बंधो में जो ऊर्जा संचित होती है वह विद्युत ऊर्जा में बदल जाती है।
एक प्रोटॉन विनिमय झिल्ली ईंधन सेल (proton exchange membrane fuel cell) में हाइड्रोजन (
H2) गैस और ऑक्सीजन गैस (
O2) को मुख्य ईंधन के रूप में काम में लिया जाता है , और जब इसमें अभिक्रिया पूर्ण होती है तो सेल में उत्पाद के रूप में जल ,
ऊष्मा और
विद्युत धारा उत्पन्न होती है।
चूँकि ऑक्सीजन को वातावरण में उपस्थित रहती है इसलिए हमें केवल हाइड्रोजन गैस देने की आवश्यकता होती है।
ईंधन सेल की कार्य प्रणाली को समझने के लिए H2–O2 सेल की सहायता ली जा सकती है।
H2–
O2 सेल में कार्बन या टाइटेनियम की दो छड काम में ली जाती है जिसमें रंध्र (छिद्र) पाए जाते है , इन्हें इलेक्ट्रोड कहा जाता है , इन दोनों इलेक्ट्रोड के मध्य में Pt का बारीक चूर्ण भरा हुआ रहता है , यह Pt का चूर्ण इलेक्ट्रोड पर होने वाली अभिक्रियाओ के लिए
उत्प्रेरक का
कार्य करता है।
साथ ही इन दोनों इलेक्ट्रोड के मध्य क्षारीय अथवा अम्लीय जल भरा हुआ रहता है , यह विद्युत अपघट्य की तरह कार्य करता है।
सेल में हाइड्रोजन तथा ऑक्सीजन गैस को उच्च दाब पर छिद्रयुक्त इलेक्ट्रोडो के द्वारा विद्युत अपघट्य में प्रवाहित किया जाता है।
इस सेल में अभिक्रिया निम्न होती है –
एनोड पर अभिक्रिया –
2H2
+ 4OH → 4H2O + 4e–
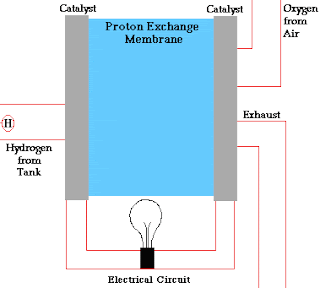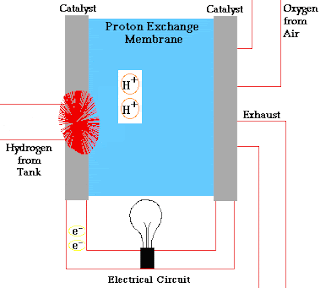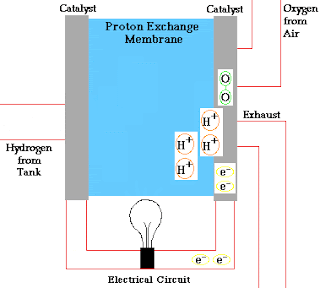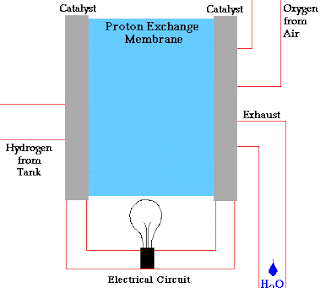
कैथोड पर क्रिया निम्न होती है –
O2
+ 2H2O + 4e → 4OH
अत: सेल पर कुल अभिक्रिया निम्न होती है –
2H2 + O2 → 2H2O (जल की बूंदें )
ईंधन सेल द्वारा विद्युत धारा या ऊर्जा कैसे प्राप्त की जाती है इस बात को हम निम्न विडियो द्वारा समझा सकते है जिसमें बताया गया है कि इस सेल में विद्युत धारा कैसे उत्पन्न होती है –
इस सेल का अंतिम लक्ष्य विद्युत धारा प्राप्त करना ही है जिसके द्वारा बाह्य स्रोतों को चलाया जाता है जैसे इसके द्वारा मोटर आदि को चलाया जा सकता है।
हम कैथोड और एनोड की अभिक्रिया में देख सकते है कि इसमें एनोड पर
इलेक्ट्रॉन का उत्सर्जन होता है और कैथोड द्वारा इलेक्ट्रॉन ग्रहण कर लिए जाते है अर्थात एनोड पर ऑक्सीकरण होता है और कैथोड पर अपचयन होता है अर्थात सेल में कुल रेडोक्स अभिक्रिया होती है जिसके कारण सेल में विद्युत धारा उत्पन्न हो जाती है।
इस सेल की सबसे अच्छी बात यह होती है की इसमें जितने लम्बे समय तक सेल में ऑक्सीजन और हाइड्रोजन गैस प्रवाहित की जाती है तब तक यह विद्युत धारा उत्पन्न करता रहता है और इसके द्वारा उत्पन्न पदार्थ वातावरण के लिए भी कोई दुष्प्रभाव नहीं रखते है।
एक सेल द्वारा उत्पन्न विद्युत धारा का मान कम होता है लेकिन अनेको इंधन सेलों को आपस में जोड़कर कई किलोवाट की शक्ति की आपूर्ति की जा सकती है अर्थात आवश्यकता के अनुसार कई सेलों को जोड़कर विद्युत ऊर्जा प्राप्त की जाती है।
उदाहरण : अपोलो अन्तरिक्ष कार्यक्रम में विद्युत ऊर्जा की आपूर्ति के लिए ईंधन सेलो का ही उपयोग किया गया था।