f center definition in hindi in chemistry centre f केंद्र किसे कहते हैं | F केन्द्र की परिभाषा क्या है ? फ या एफ ?
नॉन स्टाइकियोमीट्री दोष (non stoichiometric defect)
यौगिक जिनमें स्थिर अनुपात के नियम की पालना नहीं होती है। अर्थात धनायनों और ऋण आयनों का अनुपात , उस यौगिक के अणुसूत्र द्वारा प्रदर्शित अनुपात के बराबर नहीं होता है , वे नॉन स्टाइकियोमितीय यौगिक कहलाते है। इन यौगिकों का रासायनिक संगठन अनिश्चित अथवा परिवर्तनशील होता है , इन्हें बर्थोलाइड यौगिक भी कहते है।
इनमें धनायनों की संख्या निश्चित अनुपात से अधिक अथवा कम हो सकती है। इन्हें धनायन आधिक्य अथवा अभाव दोष कहते है। लेकिन क्रिस्टल विद्युत उदासीनता होता है जो कि अतिरिक्त इलेक्ट्रॉन की उपस्थिति अथवा अतिरिक्त धनावेश आ जाने से संतुलित होता है। इससे क्रिस्टल की संरचना में दोष उत्पन्न हो जाता है।
सामान्यतया संक्रमण धातु के यौगिक नॉन स्टाइकियोमितीय होते है। क्योंकि ये परिवर्तनशील ऑक्सीकरण अवस्था प्रदर्शित करते है।
उदाहरण – NiO , FeO , Cu2S , FeS , CuO आदि कुछ संक्रमण धातुओं के यौगिकों का रासायनिक संगठन निम्नलिखित है –
Fe0.88-1.0 S , Fe0.84-0.94O , TiO0.69-1.33 आदि।
संक्रमण धातुओं के H, C , N आदि के साथ बने अन्तराकाशी यौगिक भी नॉन स्टाइकियोमितिय होते है। उदाहरण – ZrH1.92 , VH0.56 आदि। नॉन स्टाइकियोमितिय दोष निम्नलिखित दो प्रकार के होते है –
(अ) धनायन अथवा धातु अधिक्य दोष (metal excess defect) : यह दोष क्रिस्टल जालक में धातु आयन अर्थात धनायन की अधिकता के कारण से होता है। यह दोष निम्नलिखित दो प्रकार से उत्पन्न हो सकता है –
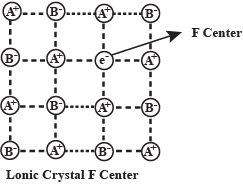
(i) ऋणायन के स्थान पर इलेक्ट्रॉन उपस्थित होने से (ऋण आयनिक रिक्तिका के कारण ) : इस दोष में कुछ ऋण आयन क्रिस्टल जालक को छोड़कर बाहर निकल जाते है और इनका स्थान इलेक्ट्रॉन ग्रहण कर लेते है। इस प्रकार क्रिस्टल जालक में धातु आयन की सांद्रता बढ़ जाती है लेकिन क्रिस्टल की उदासीनता बनी रहती है।
उदाहरण – जब NaCl की क्रिया Na वाष्प से कराते है तो पीला NaCl प्राप्त होता है जो नॉन स्टाइकियोमितीय होता है। इसका पीला रंग क्रिस्टल जालक के Cl के स्थान पर इलेक्ट्रॉन उपस्थित होने के कारण होता है। इसी प्रकार KCl को पोटेशियम वाष्प से क्रिया करने पर , यह बैंगनी या लाइलैक हो जाता है। LiCl की क्रिया Li वाष्प से कराने पर , यह गुलाबी हो जाता है।
यहाँ इलेक्ट्रॉन उपस्थिति वाले केंद्र को F-केंद्र (जर्मन शब्द Ferbe = रंग) अथवा रंग केंद्र कहते है। इनकी संख्या बढ़ने पर रंग गहरा हो जाता है। अयुग्मित इलेक्ट्रॉन के कारण , ये अनुचुम्बकीय तथा विद्युत चालक होते है। यह दोष शॉटकी दोष के समान है तथा शॉट्की दोष वाले क्रिस्टलों में पाया जाता है।
(ii) अन्तराकाश में अतिरिक्त धनायन उपस्थित होने से – इस प्रकार के दोष में कुछ अतिरिक्त धनायन , क्रिस्टल जालक के अंतराकाश में स्थान ग्रहण कर लेते है तथा क्रिस्टल की उदासीनता बनाये रखने के लिए , इलेक्ट्रॉन भी अन्य अन्तराकाश में स्थान ग्रहण कर लेते है। उदाहरण ZnO को गर्म करने पर , इसमें यह दोष उत्पन्न हो जाता है , जिससे इसका रंग पीला हो जाता है।
ZnO → Zn+2 + ½ O2 + 2e–
यह दोष फ्रेन्केल दोष के समान है। धातु आयन आधिक्य दोष वाले क्रिस्टल मुक्त इलेक्ट्रॉन के कारण , रंगीन , अनुचुम्बकीय तथा चालक होते है। ये अर्द्ध चालक (n प्रकार के अर्द्ध चालक) की तरह कार्य करते है।
(ब) धातु अथवा धनायन अभाव दोष (metal deficiency defect) : इस दोष में क्रिस्टल में धनायन अथवा धातु आयन की संख्या ऋण आयनों की तुलना में कम होती है। यह दोष निम्नलिखित दो प्रकार से उत्पन्न हो सकता है –
(i) जालक में धनायन का रिक्त स्थान : इस प्रकार के दोष में क्रिस्टल जालक में से कुछ धनायन बाहर निकल जाते है , जिससे उन स्थानों पर छिद्र बन जाते है लेकिन क्रिस्टल की उदासीनता बनाये रखने के लिए पास के अन्य धातु आयन पर अतिरिक्त धनावेश आ जाता है। यह दोष परिवर्तनशील ऑक्सीकरण अवस्था प्रदर्शित करने वाले संक्रमण धातुओं के यौगिक जैसे – FeS , NiO , FeO आदि में पाया जाता है।
(ii) अन्तराकाश में अतिरिक्त ऋण आयन की उपस्थिति : इस प्रकार के दोष में क्रिस्टल जालक के अंतराकाश में कुछ अतिरिक्त ऋणायन स्थान ग्रहण कर लेते है और क्रिस्टल की विद्युत उदासीनता बनाये रखने के लिए पास के अन्य धातु आयन उच्च ऑक्सीकरण अवस्था में बदल जाते है। सामान्यतया ऐसे दोष वाले क्रिस्टल नहीं पाए जाते है क्योंकि ऋण आयन का आकार अपेक्षाकृत बड़ा होने के कारण , यह अन्तराकाश में आसानी से स्थान ग्रहण नहीं कर सकता है।
धातु आयन अभाव दोष वाले क्रिस्टल भी अर्द्ध चालक (P प्रकार के अर्द्धचालक) की तरह कार्य करते है। इनकी चालकता उच्च ऑक्सीकरण अवस्था वाले धातु आयन के द्वारा पडोसी आयन से इलेक्ट्रॉन ग्रहण करने के कारण होती है। यह प्रक्रिया क्रिस्टल में आगे से आगे चलती रहती है।
अशुद्धि दोष (impurity defect) : अशुद्धि दोष सामान्यतया आयनिक यौगिकों में उत्पन्न किये जा सकते है। किसी आयनिक ठोस में अशुद्धि मिलाकर , कुछ आयनिक ठोसों की विद्युत चालकता बढाई जा सकती है।
यह प्रक्रिया डोपिंग (doping) कहलाती है। यह प्रक्रिया आयनिक ठोस में किसी अन्य धातु आयन को मिश्रित करके उत्पन्न करते है। उदाहरण के लिए यदि NaCl में अल मात्रा में SrCl2 मिलाकर पिघलाते है तथा फिर क्रिस्टलन करते है तो NaCl क्रिस्टल में कही कही Na+ आयन के स्थान पर Sr+2 आयन स्थान ग्रहण कर लेते है। क्योंकि Sr+2 पर +2 आवेश है इसलिए एक Sr+2 आयन के लिए दो Na+ आयन अपना स्थान छोड़ते है। जिसमें से एक स्थान Sr+2 आयन ग्रहण कर लेता है और एक स्थान रिक्त रह जाता है। इन रिक्त स्थानों के कारण ठोस की विद्युत चालकता बढ़ जाती है क्योंकि पास के अन्य आयन इस रिक्त स्थान की तरफ गति कर सकते है। अन्य उदाहरण NaCl में CaCl2 की की अशुद्धि AgCl में CdCl2 की अशुद्धि से प्राप्त ठोस है।