desilverisation of lead in hindi विरजतीकरण किसे कहते हैं परिभाषा क्या है पेटिन्सन प्रक्रम (Pattenson’s Process)
विरजतीकरण किसे कहते हैं परिभाषा क्या है पेटिन्सन प्रक्रम (Pattenson’s Process)
विरजती करण (Desilverisation of lead)
पेटिन्सन प्रक्रम (Pattenson’s Process) द्वारा सीसे से रजत पृथक करने (विरजतीकरण) को इस प्रावस्था आरेख द्वारा समझाया जा सकता है। मानाकि बिन्दु x रजत युक्त सीसे को द्रव अवस्था में प्रदर्शित करता है। जिसमें रजत का अनुपात बहुत कम (लगभग 0.25%) है। जैसे इसे ठण्डा किया जाता है, यह बिन्दु, की ओर बढ़ता है जैसे ही यह बिन्दु पर आता है, ठोस सीसा द्रव से पृथक होने लगता है और बिन्दु वक्र AO के सहारे बढ़ने लगता है अर्थात् द्रव प्रावस्था में रजत का अनुपात बढ़ने लगता है। बिन्दु 0 पर द्रव प्रावस्था में Ag का अनुपात 2.6% हो जाता है। इस प्रकार रजत युक्त सीसे में रजत का अनुपात 0.25% से 2.6% तक बढ़ जाता है।
सीमा रजत तंत्र की प्रमुख विशेषतायें संक्षेप में सारणी 4.4 में दर्शायी गयी है।
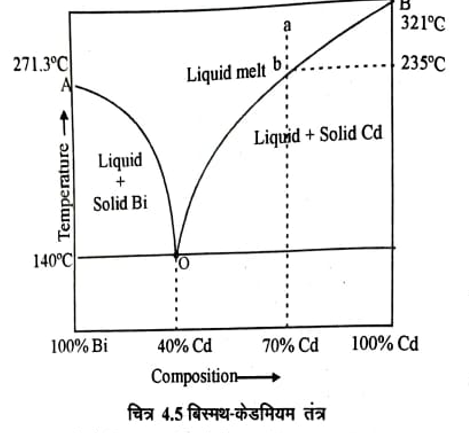
बिस्मथ-केडमियम तंत्र (Bi-Cd System )
बिस्मथ-केडमियम एक द्वि-घटक तंत्र है। इसका प्रावस्था आरेख चित्र 4.5 में दिखाया गया है। इस तंत्र में कोई यौगिक नहीं बनता है न ही ठोस प्रावस्था में कोई विलेयता है बिन्दु A शुद्ध बिस्मथ का गलनांक (271.3°C) है अर्थात् इस ताप पर ठोस व द्रव बिस्मथ साम्यवस्था में है यदि इसमें केडमीयम मिलाया जाता है तो बिस्मथ का गलनांक कम हो जाता है तथा ठोस बिस्मथ तथा केडमीयम का बिस्मथ में विलयन (द्रव) साम्यवस्था में आ जाता है। द्रव में केडमीयम का प्रतिशत शून्य से अधिक हो जाता है। इसी प्रकार धीरे-धीरे केडमीयम मिलाने पर द्रव में केडमीयम का प्रतिशत बढ़ता जाता है और वक्र AO बिस्मथ का केडमीयम की उपस्थिति में गलन वक्र (fusion curve of Bi) है।
बिस्मथ का केडमीयम की उपस्थिति में हिमांक बिन्दु में अवनमन (depression in freezing point) को प्रदर्शित करता है। इसी प्रकार वक्र BO केडमीयम का बिस्मथ की उपस्थिति में गलन वक्र (fusion ture of Cd) है वक्र AO तथा BO के प्रत्येक बिन्दु पर P = 2, C = 2 तथा F = 1 है। अतः वक्र AO व BO पर तंत्र एक चर हैं
वक्र AO तथा BO दोनों बिन्दु O पर मिलते हैं इस बिन्दु पर तीन प्रावस्थाऐं ठोस बिस्मथ, ठोस केडमीयम एवं द्रव (विलयन) साम्यवस्था में होते हैं। चूंकि P = 3, C = 2 है अतः बिन्दु O पर तंत्र अचर होगा यह बिन्दु तंत्र का गलन क्रान्तिक बिन्दु (Eutectic point) कहलाता है। इस बिन्दु पर तीनों प्रावस्थाऐं साम्यवस्था में एक निश्चित ताप ( 140°C) तथा विलयन में भार का निश्चित संघटन 40% Cd तथा 60% Bi का है। बिन्दु O पर यह संघटन 40% Cd तथा 60% Bi का ठोस मिश्रण गलन क्रान्तिक मिश्रण (Eutetic mixture) कहलाता है जिसका गलनांक 140°C है।
माना कि द्रव विलयन (liquid melt) भार का 70% Cd है जो आरेख बिन्दु a द्वारा दर्शाया गया है। को ठण्डा किया जाता है तो यह बिन्दु b (तापक्रम 235°C) की ओर बढ़ता है। जैसे ही यह बिन्दु b पर आता है। ठोस केडमीयम द्रव से पृथक होने लगता है और बिन्दु वक्र BO के सहारे बढ़ने लगता है। प्रावस्था P = 2 हो जाती है अतः तंत्र एक अचर (monovariant ) ( F = C – P + 1) हो जाता है। आगे ओर ठण्डा करने पर यह वक्र bO के अनुसार चलता है। केडमीयम के और अधिक अलग होने पर द्रव में बिस्मथ की मात्रा बढ़ती जाती है। अन्त में गलन क्रान्तिक ताप पर ठोस बिस्मथ भी अलग होता है। यहां पर प्रावस्था की संख्या तीन है दो ठोस एक द्रव और अधिक ठण्डा करने पर विलयन का जमना प्रारम्भ हो जाता है तथा यहाँ ताप व संघटन में कोई परिवर्तन नहीं होता है जब तक कि तीनों प्रावस्था उपस्थित रहती है।
पोटेशियम आयोडाइड-जल तंत्र (KI-H, O System)
यह तंत्र Pb-Ag तंत्र के समान ही है इसमें एक लवण (KI) तथा जल गलन क्रन्तिक मिश्रण बना हैं। चित्र 4.6 में KI-H2Oतन्त्र का प्रावस्था आरेख दर्शाया गया है इसकी तुलना Pb-Ag तंत्र के प्रावस्था आरेख से करने पर केवल यह अन्तर पाया जाता है कि बिन्दु B को शुद्ध KI के गलनांक तक नहीं बढ़ाया जा सकता है क्योंकि KI के गलनांक तक जल द्रव प्रावस्था में नहीं रह पाता है।
इस तंत्र की प्रमुख विशेषताऐं निम्नलिखित हैं- वक्र AO -बिन्दु A जल का हिमांक दर्शाता है। इस बिन्दु पर बर्फ व जल प्रावस्था साम्यावस्था में है। जब जल में KI मिलाया जाता है तो जल का हिमांक घटता है और वक्र AO की दिशा में बढ़ता है यह वक्र जल का हिमांक वक्र (Freezing curve) कहलाता है। इस वक्र पर बर्फ (ठोस) तथा KI का जल में विलयन प्रावस्थाऐं साम्यावस्था पर रहती है। चूंकि घटकों की संख्या 2 है, अतः स्वातन्त्र्य कोटि एक है तथा तंत्र एक चर है। इससे यह स्पष्ट है कि प्रत्येक ताप पर विलयन का संघटन निश्चित होता है ।
वक्र BO – यह वक्र KI का विलेयता वक्र (solubility curve) कहलाता है। इस वक्र पर KI ठोस तथा विलयन (द्रव) साम्य में रहते हैं। अतः P = 2 है चूंकि C = 2 है इसलिये F = 1 होगा। इस प्रकार वक्र BO पर प्रत्येक बिन्दु पर स्वातन्त्र्य कोटि एक है। वक्र को KI के गलनांक तक नहीं बढ़ाया जा सकता क्योंकि वक्र उसी ताप पर समाप्त हो जायेगा जबकि KI का संतृप्त विलयन उबलने लग जाता है।
बिन्दु “O”- यह बिन्दु गलन क्रान्तिक बिन्दु अथवा हिमक्रान्तिक बिन्दु (Cryohydric Point) कहलाता है। इस बिन्दु पर वक्र AO तथा वक्र BO मिलते हैं इस बिन्दु पर ठोस जल (बर्फ), ठोस KI तथा विलयन द्रव तीन प्रावस्थाऐं साम्य में है चूंकि P = 3, C = 2 अतः F = 0 होगा। इस प्रकार इस बिन्दु पर तंत्र अचर हैं इस बिन्दु पर तंत्र एक निश्चित ताप ( – 23°C) तथा निश्चित संघटन (52% KI) पर ही अस्तित्व में रहता है यह निश्चित ताप व संघटन क्रमशः हिम क्रान्तिक ताप (Cryohydric Temperature) तथा हिमक्रन्तिक संघटन (Cryohydric composition) कहलाते हैं।
क्षेत्र ACO – इस क्षेत्र में दो प्रावस्थाऐं (i) बर्फ (ठोस) (ii) KI जल में विलयन (द्रव), साम्य में हैं। अतः इस क्षेत्र में प्रत्येक बिन्दु पर तंत्र एक चर है। द्रव प्रावस्था का संघटन निश्चित ताप पर टाई रेखा खींचकर विलयन का संघटन ज्ञात किया जा सकता है।
वक्र OB तथा क्षैतिज रेखा OD द्वारा घिरा क्षेत्र – इस क्षेत्र में भी दो प्रावस्थायें (i) ठोस KI (ii) विलयन (द्रव) साम्य में हैं। चूंकि P = 2, C = 2 है इसलिये F = 1 होगी। इस प्रकार इस क्षेत्र में प्रत्येक बिन्दु पर तंत्र एक चर है द्रव प्रावस्था का संघटन निश्चित ताप पर टाई रेखा द्वारा ज्ञात किया जा सकता है।
वक्र AOB के ऊपर का क्षेत्र इस क्षेत्र में केवल द्रव प्रावस्था अस्तित्व में रहती है जो कि KI का जलीय विलयन है। इस क्षेत्र के प्रत्येक बिन्दु पर तंत्र द्विचर होगा। अर्थात् प्रत्येक बिन्दु पर तंत्र को पूर्ण रूप से व्यक्त करने के लिए ताप व संघटन दोनों को निश्चित करना पड़ता है।
क्षैतिज रेखा COD के नीचे का क्षेत्र- इस क्षेत्र में द्रव प्रावस्था अस्तित्व में नहीं रहती केवल बर्फ और ठोस KI अर्थात् दोनों ठोस प्रावस्था ही अस्तित्व में रहती है। इस प्रकार इस क्षेत्र में तंत्र एक चर है। जैसा कि Ag-Pb तंत्र में समझाया गया है इस क्षेत्र में भी एक हिमक्रान्तिक मिश्रण पाया जाता है। जिसमें ठोस KI 52% होता है और 48% जल बर्फ होती है।
माना कि प्रावस्था आरेख में कोई बिन्दु mi बिन्दु 0 के ऊपर है। इस क्षेत्र में केवल KI का जल में | विलयन अस्तित्व में है। इस विलयन को धीरे-धीरे ठण्डा करने पर विलयन के संघटन में कोई परिवर्तन नहीं होता है। अतः बिन्दु mO की दिशा में गिरता है बिन्दु O पर पहुंचते ही ठोस KI तथा बर्फ दोनों। साथ पृथक होने लगते हैं परन्तु विलयन का संघटन परिवर्तित नहीं होता है। O बिन्दु से नीचे सम्पूर्ण विलयन हिमक्रान्तिक मिश्रण में परिवर्तित हो जाता है।
KI- H2O तंत्र की प्रमुख विशेषताऐं संक्षेप में सारणी 4.5 में दर्शायी गई हैं।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics