colligative properties in hindi , definition , examples , अणु संख्यक गुण which of the following is not
माना शुद्ध विलायक तथा विलयन के वाष्पदाब P10 तथा P1 है तो
वाष्पदाब में अवनमन = P10 – P1
प्रश्न : वाष्पदाब का आपेक्षिक अवनमन किसे कहते है ?
उत्तर : जब शुद्ध विलायक में अवाष्पशील विलेय घोला जाता है तो वाष्प दाब कम हो जाता है इसे वाष्पदाब का अवनमन कहते है।
वाष्पदाब में अवनमन तथा शुद्ध विलायक के वाष्प दाब के अनुपात को वाष्पदाब का आपेक्षित अवनमन कहते है।
माना शुद्ध विलायक तथा विलयन के वाष्पदाब क्रमशः P10 तथा P1 है।
वाष्पदाब का आपेक्षिक अवनमन = P10 – P1/P10
अणु संख्यक गुण
तथा Tb है। अत: क्वथनांक में उन्नयन
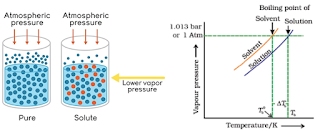
उपरोक्त तथ्य की व्याख्या निम्न ग्राफ द्वारा की जा सकती है –
चित्रानुसार विलायक तथा विलयन के लिए वाष्पदाब तथा ताप के मध्य ग्राफ खिंचा गया है –
बिंदु A पर पर विलायक का वाष्पदाब वायुमण्डलीय दाब के बराबर हो जाता है अत: बिंदु A के संगत ताप Tb0 को शुद्ध विलायक का क्वथनांक कहते है। इसी प्रकार से बिंदु B पर विलयन का वाष्प दाब वायुमंडलीय दाब के बराबर हो जाता है अत: बिंदु B के संगत ताप Tb को विलयन का क्वथनांक कहते है।
उपरोक्त ग्राफ से स्पष्ट है कि विलयन का क्वथनांक शुद्ध विलायक के क्वथनांक से अधिक होता है।
प्रयोगों द्वारा यह ज्ञात हुआ कि क्वथनांक में उन्नयन विलयन की सांद्रता (मोललता) के समानुपाती होता है
अर्थात –
△Tb ∝ m समीकरण-1
माना Kb मोलल उन्नयन स्थिरांक या क्वथनांक उन्नयन स्थिरांक है इसे निम्न प्रकार से परिभाषित किया जाता है।
यदि m = 1 मोलल है तो समीकरण-1 से
△Tb = Kb
एक मोलल विलयन के क्वथनांक में उन्नयन को मोलल उन्नयन स्थिरांक कहते है।
हिंदी माध्यम नोट्स
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi sociology physics physical education maths english economics geography History
chemistry business studies biology accountancy political science
Class 12
Hindi physics physical education maths english economics
chemistry business studies biology accountancy Political science History sociology
English medium Notes
Class 6
Hindi social science science maths English
Class 7
Hindi social science science maths English
Class 8
Hindi social science science maths English
Class 9
Hindi social science science Maths English
Class 10
Hindi Social science science Maths English
Class 11
Hindi physics physical education maths entrepreneurship english economics
chemistry business studies biology accountancy
Class 12
Hindi physics physical education maths entrepreneurship english economics