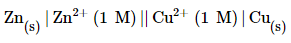सेल का विद्युत वाहक बल अथवा सैल विभव क्या होता है , सूत्र , si इकाई , विमा , मात्रक (emf of the cell or cell potential in hindi)
(emf of the cell or cell potential in hindi) सेल का विद्युत वाहक बल अथवा सैल विभव क्या होता है , सूत्र , si इकाई , विमा , मात्रक : किसी भी विद्युत रासायनिक सेल या गैल्वेनिक सेल आदि में दो इलेक्ट्रोड उपस्थित रहते है जिन्हें अर्द्ध सेल कहते है , इनमे से एक इलेक्ट्रोड की प्रवृत्ति इलेक्ट्रॉन त्यागने की होती है , इलेक्ट्रॉन त्यागने के कारण इस इलेक्ट्रोड पर धन आवेश आ जाता है और इस इलेक्ट्रोड पर होने वाली अभिक्रिया ऑक्सीकरण अभिक्रिया होती है इसलिए इस इलेक्ट्रोड के इलेक्ट्रॉन त्यागने की प्रवृत्ति के माप को ऑक्सीकरण विभव कहते है।
दूसरे इलेक्ट्रोड की प्रवृत्ति इलेक्ट्रॉन ग्रहण करने की होती है , इलेक्ट्रॉन ग्रहण करने के कारण यह इलेक्ट्रोड ऋण आवेशित हो जाता है तथा इस इलेक्ट्रोड पर संपन्न होने वाली अभिक्रियाएँ अपचयन अभिक्रिया होती है और इसी कारण इस इलेक्ट्रोड के इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति के मापन को अपचयन विभव कहते है।
दोनों अर्द्ध सेलों या दोनों इलेक्ट्रोड के मध्य विभव के अंतर को ही सेल का विद्युत वाहक बल या सेल का विभव अथवा सैल वोल्टता कहलाता है।
अर्थात दोनों इलेक्ट्रोड के विभवो के मान में जितना ज्यादा अंतर होगा सेल का विद्युत वाहक बल उतना ही अधिक होता है।
अत: इसको निम्न प्रकार परिभाषित कर सकते है –
सेल का विद्युत वाहक बल : वोल्टिक या गैल्वेनिक सेल के इलेक्ट्रोडो के मध्य अधिकतम विभवान्तर या विभव में अंतर के मान को सेल का विद्युत वाहक बल या सेल का विभव कहते है।
यह किसी भी तत्व , यौगिक या आयन की इलेक्ट्रॉन ग्रहण करने या त्यागने की क्षमता को दर्शाता है।
दूसरे इलेक्ट्रोड की प्रवृत्ति इलेक्ट्रॉन ग्रहण करने की होती है , इलेक्ट्रॉन ग्रहण करने के कारण यह इलेक्ट्रोड ऋण आवेशित हो जाता है तथा इस इलेक्ट्रोड पर संपन्न होने वाली अभिक्रियाएँ अपचयन अभिक्रिया होती है और इसी कारण इस इलेक्ट्रोड के इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति के मापन को अपचयन विभव कहते है।
दोनों अर्द्ध सेलों या दोनों इलेक्ट्रोड के मध्य विभव के अंतर को ही सेल का विद्युत वाहक बल या सेल का विभव अथवा सैल वोल्टता कहलाता है।
अर्थात दोनों इलेक्ट्रोड के विभवो के मान में जितना ज्यादा अंतर होगा सेल का विद्युत वाहक बल उतना ही अधिक होता है।
अत: इसको निम्न प्रकार परिभाषित कर सकते है –
सेल का विद्युत वाहक बल : वोल्टिक या गैल्वेनिक सेल के इलेक्ट्रोडो के मध्य अधिकतम विभवान्तर या विभव में अंतर के मान को सेल का विद्युत वाहक बल या सेल का विभव कहते है।
यह किसी भी तत्व , यौगिक या आयन की इलेक्ट्रॉन ग्रहण करने या त्यागने की क्षमता को दर्शाता है।
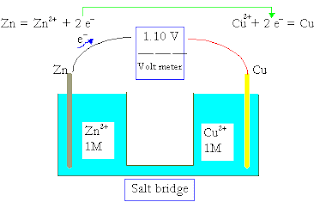
जैसे जिंक और कॉपर के मध्य अधिकतम विद्युत वाहक बल का मान 1.1 वोल्ट होता है।
नियम के अनुसार किसी सेल का विद्युत वाहक बल का मान ज्ञात करने के लिए कैथोड के इलेक्ट्रोड विभव में से एनोड के इलेक्ट्रोड विभव का मान घटाया जाता है , जिससे सेल का emf प्राप्त हो जाता है , इस नियम के अनुसार देखे तो सेल का emf (वि.वा.बल) का मान हमेशा धनात्मक प्राप्त होता है।
सेल का विभव = कैथोड का विभव – एनोड का विभव
इलेक्ट्रोड विभव का मापन कैसे किया जाता है
कभी भी एक इलेक्ट्रोड का अर्द्ध सेल के विभव का मापन संभव नहीं है , इसलिए दोनों इलेक्ट्रोडो के विभव के अंतर को मापा जाता है जिसे इलेक्ट्रोडो का विभवान्तर या सेल का विद्युत वाहक बल या सेल विभव कहते है।
किसी भी एक इलेक्ट्रोड का विभव का मान ज्ञात करने के लिए दुसरे इलेक्ट्रोड के विभव के मान को स्वेच्छा से निर्धारित किया जाता है और जिस इलेक्ट्रोड के विभव के मान को स्वेच्छा से माना जाता है उसे सन्दर्भ इलेक्ट्रोड कहते है। परिपाटी के अनुसार मानक हाइड्रोजन इलेक्ट्रोड को सन्दर्भ इलेक्ट्रोड के रूप में काम में लिया जाता है। मानक हाइड्रोजन इलेक्ट्रोड के विभव के मान को स्वेच्छा से शून्य माना जाता है और इस इलेक्ट्रोड के सन्दर्भ में किसी भी इलेक्ट्रोड का विभव ज्ञात किया जाता है।