असामान्य मोलर द्रव्यमान (abnormal molar mass in hindi) , वान्ट हाफ गुणांक
अगर ये शर्ते पूरी हो रही है तो विलेय पदार्थ का मोलर द्रव्यमान अणु संख्यक गुणों की सहायता से ज्ञात किया जा सकता है।
लेकिन जब किसी विलायक में ऐसा पदार्थ घोला जाए अर्थात ऐसा विलेय घोला जाए जो विलायक में आयनन या संगुणन (संयोजन) हो जाए तो इस स्थिति में विलयन में कणों की संख्या अर्थात मोलों की संख्या में वृद्धि या कमी हो जाती है जिसके कारण इसके अणु संख्यक गुणों में भी परिवर्तन हो जाता है , इस स्थिति में विलेय के मोलर द्रव्यमान को अणुसंख्यक गुणों की सहायता से सही ज्ञात नहीं किया जा सकता है।
जैसे जब NaCl का 1 मोल अर्थात 58.5 ग्राम को जल में घोला जाता है और हम विलयन में विलेय का एक मोल होना चाहिए लेकिन NaCl का जल में विद्युत अपघट्न हो जाता है अर्थात NaCl , Na+ और Cl- आयनों में टूट जाता है या आयनित हो जाता है इसलिए विलयन में हमे एक मोल Na+ का मिलता है और 1 मोल Cl- का प्राप्त हो जाता है अर्थात विलयन में कुल दो मोल प्राप्त हो जाते है इसलिए इसके अणु संख्यक गुण 2 मोलो के अनुरूप प्राप्त होते है अर्थात बदल जाते है इसलिए हम NaCl का मोलर द्रव्यमान अणुसंख्यक गुणों के आधार पर ज्ञात नहीं कर सकते है , अगर ज्ञात करेंगे तो यह पूर्ण रूप से सही प्राप्त नहीं होता है।
अगर हम यहाँ अणु संख्यक गुण के आधार पर मोलर द्रव्यमान ज्ञात करे तो –
यहाँ NaCl का मोलर द्रव्यमान 1/2 अर्थात आधा प्राप्त होता है अर्थात इस स्थिति में विलयन में NaCl का मोलर द्रव्यमान 58.5/2 = 29.25 प्राप्त होता है जो सही न है।
इसी प्रकार जब किसी विलेय पदार्थ का विलायक में संगुणन हो जाता है तो भी मोलर द्रव्यमान का सही मान , अणु संख्यक गुणों के आधार पर ज्ञात नहीं किया जा सकता है क्यूंकि संगुणन होने के कारण विलयन में कणों की संख्या में कमी आ जाती है जिससे विलेय पदार्थ का अणु भार , सामान्य से अधिक प्राप्त होता है।
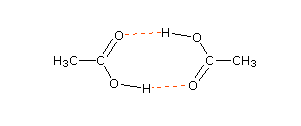
जैसे जब CH3COOH को C6H6 विलायक में घोला जाता है तो , CH3COOH का संयोजन हो जाता है जिससे यह द्विलक बना लेता है , अणुसंख्यक गुण के आधार पर इसका मोलर द्रव्यमान ज्ञात करने पर सामान्य से दोगुना प्राप्त होता है।
असामान्य मोलर द्रव्यमान : ऐसे मोलर द्रव्यमान जो सामान्य मोलर द्रव्यमान की तुलना में अधिक या कम प्राप्त होते है उन्हें विलेय पदार्थ का असामान्य मोलर द्रव्यमान कहते है , यह विलेय पदार्थ के विलयन में संगुणन या आयनन के कारण होता है।
वांट हॉफ ने एक वांटहॉफ गुणांक का प्रतिपादन किया , इस गुणांक की सहायता से विलेय के संगुणन या आयनन की मात्रा को ज्ञात किया जा सकता है।
वांट हॉफ गुणांक को i द्वारा व्यक्त करते है।
i = प्रेक्षित अणु संख्यक गुण/सैधांतिक अणुसंख्यक गुण
यदि वांट हॉफ गुणांक (i) का मान 1 प्राप्त होता है तो मतलब विलेय का संगुणन या आयनन नहीं हुआ है।
जब वांट हॉफ (i) का मान एक से अधिक प्राप्त हुआ है तो विलेय का आयनन या वियोजन हुआ है।
जब वांटहॉफ (i) का मान एक से कम आता है तो इस स्थिति में विलेय का संगुणन हुआ है।
वांट हॉफ को सम्मिलित करने के बाद , अणु संख्यक गुणों के समीकरण द्वारा विलेय का सही मोलर द्रव्यमान ज्ञात किया जा सकता है।
वान्ट हाफ गुणांक सम्मिलित करने के बाद , अणु संख्यक गुण की समीकरण निम्न प्रकार प्राप्त होती है –