रदरफोर्ड का परमाणु मॉडल क्या है कमियां , दोष या सीमाएं rutherford atomic model in hindi
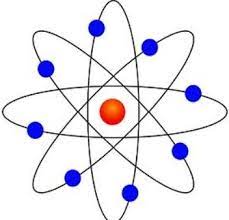
(rutherford atomic model in hindi) रदरफोर्ड का परमाणु मॉडल : अल्फा प्रकीर्णन प्रयोग के बाद रदरफोर्ड ने यह देखा कि थॉमसन का परमाणु मॉडल पूरी तरह से ठीक नहीं है।
रदरफोर्ड ने अपने अल्फा प्रकीर्णन प्रयोग के आधार पर कुछ निष्कर्ष निकाले और इनके आधार पर अपना परमाणु मॉडल प्रस्तुत किया।
रदरफोर्ड का परमाणु मॉडल
इस परमाणु मॉडल के मुख्य बिंदु निम्न है –
- परमाणु का अधिकांश द्रव्यमान एक बहुत ही छोटे हिस्से में विद्यमान रहता है , इसे नाभिक कहते है। अर्थात परमाणु का लगभग सम्पूर्ण द्रव्यमान द्रव्यमान में विद्यमान रहता है। बाद में यह पाया गया कि नाभिक अत्यंत छोटा और सघन होता है जिसमें न्यूट्रॉन और प्रोटॉन उपस्थित रहते है।
- इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं में चक्कर लगाते रहते है , कक्षाएं एक निश्चित वृत्ताकार पथ होता है जिसमे इलेक्ट्रॉन नाभिक के चारों ओर बहुत अधिक वेग से गति करता रहता है।
- किसी भी परमाणु पर कुल आवेश शून्य होता है क्यूंकि इलेक्ट्रॉन पर ऋणात्मक आवेश होता है और नाभिक धनावेशित होती है , दोनों के मध्य स्थिरवैधुतिकी आकर्षण बल पाया जाता है जिससे नाभिक इलेक्ट्रॉन को जकड़े रहता है।
- नाभिक का आकार , परमाणु की तुलना में बहुत कम होता है।
- परमाणु के केंद्र में नाभिक पायी जाती है और इसका आकार लगभग 10-14 मीटर की कोटि की होती है , नाभिक में परमाणु का सम्पूर्ण धनात्मक आवेश और द्रव्यमान उपस्थित रहता है। नाभिक में उपस्थित आवेश को +Ze द्वारा व्यक्त करते है यहाँ Z = उस परमाणु का परमाणु क्रमांक होता है तथा e = इलेक्ट्रॉन पर उपस्थित आवेश।
- परमाणु एक खोखले गोले के समान होता है और इसके केंद्र पर उपस्थित नाभिक के चारों ओर इलेक्ट्रॉन निश्चित कक्षाओं में चक्कर लगाते रहते है।
रदरफोर्ड के परमाणु मॉडल की कमियां , दोष या सीमाएं
रदरफोर्ड के मॉडल में कुछ कमियां रही जिसे समझाने में वे असमर्थ रहे , वे कमियां निम्न है –
- रदरफोर्ड ने बताया कि इलेक्ट्रॉन , नाभिक के चारों ओर चक्कर लगाते रहते है , अगर ऐसा होता है तो इससे परमाणु के स्थायित्व को नहीं समझाया जा सकता। क्यूंकि यदि इलेक्ट्रॉन वृत्तिय कक्षाओं में चक्कर लगा रहा है तो विद्युत चुम्बकत्व के सिद्धांत के आधार पर इलेक्ट्रॉन चक्कर लगाते हुए ऊर्जा का उत्सर्जन करेगा और अंततः इलेक्ट्रॉन की ऊर्जा खत्म हो जाएगी जिससे इलेक्ट्रॉन नाभिक में गिर जायेगा , लेकिन ऐसा संभव नहीं है , इस बात को रदरफोर्ड के परमाणु मॉडल द्वारा नहीं समझाया जा सकता है।
- नाभिक के चारों ओर इलेक्ट्रॉन का वितरण किस प्रकार से होता है , यह भी इसमें नहीं समझाया गया।
- रदरफोर्ड के इस परमाणु मॉडल के आधार पर परमाणु का स्पेक्ट्रम सतत होना चाहिए लेकिन व्यावहारिक रूप में परमाणु का स्पेक्ट्रम रेखीय होता है।