गैसों के गतिक सिद्धान्त के मान्यतायें क्या हैं ? गैस के अणुगतिक समीकरण की व्युत्पत्ति Derivation of the Kinetic Equation for Gases
Derivation of the Kinetic Equation for Gases in hindi गैसों के गतिक सिद्धान्त के मान्यतायें क्या हैं ? गैस के अणुगतिक समीकरण की व्युत्पत्ति कीजिए ?
गैसों का अणुगति सिद्धान्त (KINETIC MOLECULAR THEORY OF GASES) : गैसों के व्यवहार के सम्बन्ध में अब तक हमने जितने भा नियम पढ़ व सब प्रायोगिक तथ्यों पर आधारित औसा क्यों होता है? इसकी व्याख्या गैसों के अणुगति सिद्धान्त के आधार पर की जा सकती है जिसे सर्वप्रथम बरनौली (Bernoulli) ने सन् 1738 में दिया और बाद में क्लाउसियस, मैक्सवेल, बोल्टजमैन कोनिंग, केल्विन, वाण्डर वाल, आदि कई वैज्ञानिकों ने इसको विकसित किया।
गैसों के अणुगति सिद्धान्त के प्रमुख अभिगृहीत (Important Postulates of Kinetic Theory of Gases) –
(1) प्रत्येक गैस सूक्ष्म कणों से मिलकर बनी हुई होती है, जिन्हें अणु (molecules) कहा जाता है।
(2) किसी एक गैस के समस्त अणु एक-दूसरे के बिल्कुल समान होते हैं लेकिन ये अन्य गैसों के अणुओं से भिन्न होते हैं।
(3) गैसों के अणुओं की सूक्ष्म, गोल व कठोर कणों के रूप में कल्पना की गई है जिनका आयतन गैस के कुल आयतन की तुलना में नगण्य माना गया है।
(4) गैस के अणु लगातार गति में रहते हैं। ये हर सम्भव दिशा में गति करते हैं। इनका वेग बहुत अधिक होता है और चाहे कोई भी दिशा हो ये सदैव सीधी रेखा में गति करते हैं। जब ये पात्र की दीवारों के साथ अथवा परस्पर एक-दूसरे के साथ टकराते हैं तो किसी अन्य दिशा में लेकिन पुनः सीधी रेखा में गमन करते लगते हैं।
(5) गैस के अणु जब पात्र की दीवारों से टकराते हैं तो पात्र की दीवारें बल को अनुभव करती हैं और इकाई आयतन पर गैस अणुओं द्वारा लगाया जाने वाला बल ही गैसीय दाब होता है।
(6) गैस के अणुओं को ठोस गोलाकार होने के साथ-साथ पूर्णरूप से प्रत्यास्थ (perfectly elastic) भी माना गया है जिससे उनकी परस्पर टक्करों से अथवा पात्र की दीवारों के साथ टक्कर होने से उनकी ऊर्जा बिल्कुल भी नष्ट नहीं होती।
(7) गैस अणुओं के मध्य परस्पर कोई आकर्षण-प्रतिकर्षण नहीं होता और इनकी गति पर गुरुत्वाकर्षण बल का भी कोई प्रभाव नहीं पड़ता।
(8) किसी गैस के समस्त अणुओं की औसत गतिज ऊर्जा का मान गैस के परम ताप के अनुक्रमानुपाती होता है।
(9) समस्त अणुओं के वेग व ऊर्जा समान नहीं होते, अतः अणुओं के वेग या ऊर्जा से तात्पर्य होता है, उनका औसत वेग या औसत ऊर्जा।
गैसों के लिए अणुगति समीकरण व्युत्पन्न (Derivation of the Kinetic Equation for Gases)
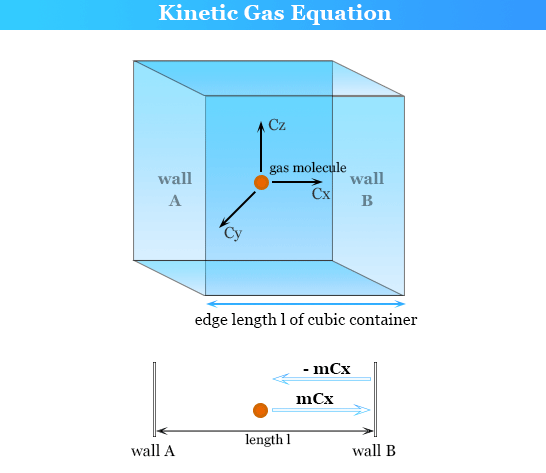
माना कि घन के आकार में एक बॉक्स है जिसमें कोई गैस भरी हुई है। माना कि
(i) बॉक्स की एक भुजा की लम्बाई = 1 cm
(ii) गैस में विद्यमान अणुओं की कुल संख्या = n
(iii) प्रत्येक अणु का द्रव्यमान = m ग्राम (iv) अणुओं का माध्य वेग = Vx cm/s
माना कि एक अणु घनाकार बॉक्स की आमने सामने की दो दीवारों A व B के मध्य गति कर रहा है (चित्र 3.3), अतः वह बार-बार दीवार A व B के साथ टकराता जा रहा है। चूंकि टक्कर पूर्णतया प्रत्यास्थ (elastic) होती है अतः दीवार A के साथ टकराने से पहले तथा टकराने के बाद में उसका वेग तो वही रहता है. बस उसकी दिशा विपरीत हो जाती है। अतः दीवार A पर एक अणु द्वारा टक्कर मारने से पूर्व का संवेग =mv. और टक्कर मारने के बाद का संवेग में परिवर्तन = mvx प्रत्येक टक्कर में संवेग में परिवर्तन =mvx (-mvx ) = 2myx
उदाहरण 3.1. 3000 K पर दो मोल CO, गैस की गतिज ऊर्जा का परिकलन कीजिये। गतिज ऊर्जा = 3/2 n RT
मान रखने पर, गतिज ऊर्जा= 3 x 2 x 8.314 x 3000 = 7.48 x10 किलो जूल CO2 के दो मोल की गतिज ऊर्जा = 7.48×10*kJ समीकरण की सीमाएं (Limitations of Ideal Gas Equation)
आदर्श गैस समीकरण की सीमाएं (Limitations of Ideal Gas Equation)
PV = nRT को आदर्श गैस समीकरण कहते हैं, जो गैसें दाब व ताप के प्रत्येक मान पर इस समीकरण से पालन करती हैं, आदर्श गैसें कहलाती हैं। किन्तु वास्तव में कोई भी गैस पूर्णरूप से आदर्श व्यवहार नहीं करती है। उदाहरण के लिए, बॉयल के नियमानसार यदि स्थिर ताप पर किसी गैस का दाब दुगना कर दिया जाये तो आयतन आधा हो जाना चाहिए और यदि दाब को चार गुणा कर जाये तो आयतन एक-चौथाई (1/4 ) हो जाना चाहिए और आयतन घटते-घटते एक अवस्था ऐसी आनी जाहिए जबकि गैस का आयतन शून्य रह जाये, क्योंकि P- V/ l
किन्तु वास्तव में ऐसा हाता नहा हा हाता यह है कि जब गैस का दाब बढाया जाता है तो गैस का जाता है अर्थात इसका घनत्व बढ़ जाता है। जब गैसों का घनत्व बढ़ जाता है तो दाब बढ़ने न में कमी अर्थात गैसों के दबने की सामर्थ्य जिसे हम संपीड्यता (compressibility) की जाती है। दूसरे शब्दों में, उच्च दाब पर दाब बढ़ने के साथ आयतन में उतनी कमी नहीं आती जननी कि आनी चाहिए अर्थात् इसका व्यवहार आदर्श गैस से विचलित हो जाता है। सीपकार चार्ल्स व गै-लूसाक के नियमानुसार स्थिर दाब पर किसी गैस के ताप में कमी करने से उसका आयतन भी कम हो जाना चाहिए क्योंकि V – T अर्थात ताप जितना बढता जायेगा, आयतन भी बढ़ता जायेगा और ताप में कमी के साथ उसके आयतन में भी कमी आती जायेगी. इस प्रकार एक अवस्था ऐसी आनी चाहिए (गैस के – 273°C ताप पर) कि गैस का आयतन शून्य हो जाना चाहिए, जबकि वास्तव में ऐसा सम्भव नहीं है।
tag : गैस के अणुगति सिद्धांत के आधार पर बॉयल नियम की व्याख्या कीजिए। गैस के गतिक समीकरण की मदद से बॉयल एवं चार्ल्स के नियमों की व्युत्पति किस प्रकार होती है?