What is diffusion (विसरण ) and osmosis (परासरण) is definition formula and questions विसरण तथा परासरण क्या है परिभाषा सूत्र व प्रश्न उत्तर in hindi
विसरण :
पदार्थ के अणु अधिक सान्द्रता वाले क्षेत्र से कम सांद्रता वाले क्षेत्र की ओर स्वतः ही गति करते है जब तक की सभी जगह सान्द्रता समान न हो जाये।
उदाहरण : जल में स्याही की बून्द डालने पर समांगी विलयन का बनना।
परासरण :
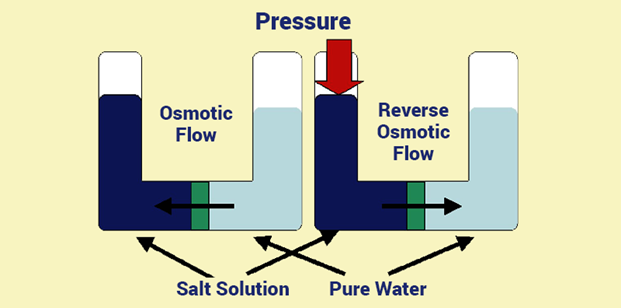
अर्द्ध पारगम्य छिल्ली द्वारा जल के अणुओं कम सान्द्रता वाले विलयन से अधिक सांद्रता वाले विलयन की ओर जाना परासरण कहलाता है।
एक U आकार की काँच की नाली के मध्य में अर्द्ध पारगम्य छिल्ली व्यवस्थित करके उसमे एक तरफ जल व दूसरी तरफ विलयन भर लेते है। जल तथा विलयन की सतह पर जल रोधी पिस्टन लगे होते है। परासरण की क्रिया द्वारा जल के अणु शुद्ध जल से विलयन की ओर प्रवेश करते है जिससे विलयन की सतह पर लगा पिस्टन ऊपर की ओर सरकने लगता है। इस पिस्टन के पुन: उसी अवस्था में लाने के लिए विलयन की सतह पर जो दाब डाला है उसे परासरण दाब कहते है।
अतः
अर्द्ध पारगम्य छिल्ली द्वारा जल के अणुओं का विलायक से विलयन में प्रवेश करने के लिए विलयन की सतह पर जो दाब डाला जाता है उसे परासरण दाब कहते है। इसे π से व्यक्त करते है।
डाइग्राम
परासरण दाब ज्ञात करने के लिए वांटहॉफ ने निम्न समीकरण दिया।
πv = nRT
यहाँ π = परासरण दाब
v = विलयन का आयतन लीटर में।
n = विलेय के मोल
R = गैस नियतांक (0.08212 atm K-1mol-1)
या
π = nRT/v
चूँकि : n / v = C (मोलर सांद्रता )
अतः
π = CRT
यदि विलेय के मोल n = W2/M2
अतः समीकरण से
πv = RTW2/M2
नोट : दो समान सान्द्रता वाले विलयनों का परासरण दाब समान होता है। इन्हें सम परासरी विलयन( isotonic सलूशन) कहते है।
नोट : दो अलग अलग सान्द्रता वाले विलयनों में से वह विलयन जिसका परासरण दाब अधिक होता है उसे अति परासरी (hyper tonic solution ) कहते है। तथा वह विलय जिसका परासरण दाब कम होता है उसे hypotonic solution (अल्प परासरी ) विलयन कहते है।
प्रश्न 1 : 27 डिग्री सेंटीग्रेट ताप पर 18% w/v ग्लूकोज़ के विलयन का परासरण दाब ज्ञात करो।
उत्तर : R = 0.01812 L atm K-1mol-1
ग्लूकोज़ का मोलर द्रव्यमान 180
10% w/v ग्लूकोज़ के विलयन का अर्थ है 18 ग्राम ग्लूकोज़ 100 ml जलीय विलयन में घुला हुआ है।
πv = nRT
π = RTW2/v M2
π = ? M2 = 18 gm
v = 100 ml या 0.1 L
R = 0.01812 L atm K-1mol-1
T = 27 + 273 = 300
π = RTW2/v M2
π = 24.6300 atm