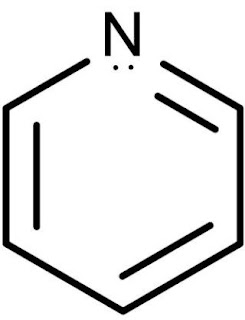
(pyridine in hindi ) पिरिडीन : अणुसूत्र = C5H5N
IUPAC नाम : एजीन
पिरिडीन की संरचना निम्न है –
IUPAC नाम : एजीन
पिरिडीन की संरचना निम्न है –
बनाने की विधियाँ –
1. एसिटिलीन द्वारा : एसीटिलीन व HCN मिश्रण को Fe की लाल तप्त नलिका से प्रवाहित करने पर पिरिडीन बनता है।
2. टेट्रा हाइड्रो फर्फयुरल एल्कोहल : इसको उच्च ताप पर अमोनिया के साथ गर्म करने पर पिरिडीन बनता है।
3. हेन्स संश्लेषण : एथिल एसिटो एसिटेट की एल्डिहाइड व NH3 के साथ अभिक्रिया कराने पर 1,4 डाई हाइड्रो पिरिडीन प्राप्त होती है जो HNO3 द्वारा ऑक्सीकृत होकर पिरिडीन व्युत्पन्न बनाता है।
इस अभिक्रिया में एथिल एसिटो एसिटेट का इनोलिक रूप काम में आता है।
संरचना एवं ऐरोमैटिकता
1. पिरिडीन का अणुसूत्र C5H5N होता हैं।
2. इसमें सभी C और N परमाणु का संकरण sp2 होता है। अत: यह चक्रीय तथा समतलीय होता है।
3. इसमें विस्थानिकृत 6πe होते है अत: यह हकल के (4n + 2 )πe नियम की पालना करता है।
4. यह योगात्मक अभिक्रिया की बजाय electron स्नेही प्रतिस्थापन अभिक्रियायें दर्शाता है जो एरोमेटिक यौगिकों का मुख्य लक्षण है।
5. पिरिडीन वलय में चक्रीय अनुनाद पाया जाता है जिसे निम्न प्रकार दर्शाते है
रासायनिक गुण
1. क्षारीय गुण : पिरिडीन में N पर loan pair उपस्थित होने के कारण यह क्षारीय गुण दर्शाता है , यह अम्लों से क्रिया करके लवण बनाता है।
प्रश्न : क्या कारण है की पिरिडीन , एलिफेटिक तृतीयक एमीन से कम क्षारीय होता है ?
उत्तर : पिरिडीन में N परमाणु sp2 संकरित होता है। जिससे इसमें N का loan pair sp2 संकरित कक्षक में उपस्थित रहता है।
एलीफैटिक तृतीयक एमिन में N परमाणु का संकरण sp3 होता है।
sp2 संकरित N की विद्युत ऋणता sp3 संकरित नाइट्रोजन की अपेक्षा अधिक होने के कारण पिरिडीन में loan pair की उपलब्धता एलीफेटिक 3 डिग्री एमीन से कम हो जाती है , इस कारण या एलीफैटिक 3 डिग्री एमीन से कम क्षारीय होता है।
2. ऐरोमेटिक इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रियाएँ :
क्रियाशीलता : पिरिडीन πe न्यून एरोमेटिक चक्रीय यौगिक है , इसमें N परमाणु का संकरण sp2 होने से इसकी विद्युत ऋणता अधिक होने के कारण यह -I प्रभाव दर्शाता है , जिससे N परमाणु वलय के इलेक्ट्रोन आकर्षित कर लेता है , फलस्वरूप वलय का इलेक्ट्रॉन घनत्व कम हो जाता है , इस कारण पिरिडीन की इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रियाओं के प्रति क्रियाशीलता बेंजीन से भी कम हो जाती है।
अभिविन्यास : पिरिडीन की अनुनादी संरचनाओं से स्पष्ट होता है कि इसमें 2,4 व 6 स्थितियों पर धनावेश उपस्थित रहता है , अतः यहाँ इलेक्ट्रॉन घनत्व कम रहता है एवं स्थिति 2 पर इलेक्ट्रॉन स्नेही के आक्रमण से बना कार्ब धनायन ( σ संकुल ) कम स्थायी होता है , इन कारणों से पिरिडीन वलय में एरोमैटिक इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रिया स्थिति 3 या 5 पर संपन्न होती हैं।
अतः पिरिडीन वलय में इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रिया स्थिति 3 या 5 पर सम्पन्न होती हैं।
प्रश्न : क्या कारण है की पिरिडीन , एलिफेटिक तृतीयक एमीन से कम क्षारीय होता है ?
उत्तर : पिरिडीन में N परमाणु sp2 संकरित होता है। जिससे इसमें N का loan pair sp2 संकरित कक्षक में उपस्थित रहता है।
एलीफैटिक तृतीयक एमिन में N परमाणु का संकरण sp3 होता है।
sp2 संकरित N की विद्युत ऋणता sp3 संकरित नाइट्रोजन की अपेक्षा अधिक होने के कारण पिरिडीन में loan pair की उपलब्धता एलीफेटिक 3 डिग्री एमीन से कम हो जाती है , इस कारण या एलीफैटिक 3 डिग्री एमीन से कम क्षारीय होता है।
2. ऐरोमेटिक इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रियाएँ :
क्रियाशीलता : पिरिडीन πe न्यून एरोमेटिक चक्रीय यौगिक है , इसमें N परमाणु का संकरण sp2 होने से इसकी विद्युत ऋणता अधिक होने के कारण यह -I प्रभाव दर्शाता है , जिससे N परमाणु वलय के इलेक्ट्रोन आकर्षित कर लेता है , फलस्वरूप वलय का इलेक्ट्रॉन घनत्व कम हो जाता है , इस कारण पिरिडीन की इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रियाओं के प्रति क्रियाशीलता बेंजीन से भी कम हो जाती है।
अभिविन्यास : पिरिडीन की अनुनादी संरचनाओं से स्पष्ट होता है कि इसमें 2,4 व 6 स्थितियों पर धनावेश उपस्थित रहता है , अतः यहाँ इलेक्ट्रॉन घनत्व कम रहता है एवं स्थिति 2 पर इलेक्ट्रॉन स्नेही के आक्रमण से बना कार्ब धनायन ( σ संकुल ) कम स्थायी होता है , इन कारणों से पिरिडीन वलय में एरोमैटिक इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रिया स्थिति 3 या 5 पर संपन्न होती हैं।
अतः पिरिडीन वलय में इलेक्ट्रोफिलिक प्रतिस्थापन अभिक्रिया स्थिति 3 या 5 पर सम्पन्न होती हैं।
पिरिडीन की नाभिक स्नेही प्रतिस्थापन अभिक्रियाएँ
क्रियाशीलता : पिरिडीन में नाइट्रोजन परमाणु के -I प्रभाव के कारण वलय में इलेक्ट्रॉन की कमी हो जाती है , जिसके कारण पिरिडीन वलय में C परमाणुओं पर धनावेश उत्पन्न हो जाता है , फलस्वरूप पिरिडीन वलय में नाभिक स्नेही प्रतिस्थापन अभिक्रिया संपन्न होती हैं।
अभिविन्यास : पिरिडीन वलय में N परमाणु के -I प्रभाव के कारण वलय के कार्बन विशेष रूप से 2,4,6 स्थितियों पर इलेक्ट्रॉन की कमी से धनावेश उत्पन्न हो जाता है , इस कारण नाभिक स्नेही का आक्रमण पिरिडीन वलय स्थिति 2 या 4 पर संपन्न होता हैं।
इसके अलावा स्थिति 2 या 4 न्यूक्लिओ फिलिक /नाभिक स्नेही के आक्रमण से बना मध्यवर्ती ऋणायन अधिक स्थायी होता हैं।
अतः पिरिडीन वलय में नाभिक स्नेही प्रतिस्थापन अभिक्रियाएँ 2,4 या 6 पर सम्पन्न होती हैं।
नाभिक स्नेही प्रतिस्थापन अभिक्रिया के उदाहरण
1. KOH के साथ क्रिया
2. सोडा लाइम के साथ क्रिया (चिचिबेबन अभिक्रिया ) : जब पिरिडीन की सोडामाइम के साथ द्रव अमोनिया की उपस्थिति में अभिक्रिया करायी जाती है तो एमिनो पिरिडीन मुख्य उत्पाद प्राप्त होता है।
इसे चीचीबेबन अभिक्रिया कहते हैं।
3. एल्किल या एरिल लिथियम के साथ अभिक्रिया
4. R-MgX के साथ अभिक्रिया