First order reaction (प्रथम कोटि की अभिक्रिया) velocity equation and half time with examples and question answers velocity equation and half time with examples in hindi
प्रथम कोटि की अभिक्रिया का समाकलित वेग समीकरण :
जब किसी अभिक्रिया का वेग क्रियाकरको की सांद्रता के प्रथम घात के समानुपाती होता है। तो इसे प्रथम कोटि की अभिक्रिया कहते है।
माना एक अभिक्रिया निम्न है।
R → उत्पाद
माना प्रारम्भ में अर्थात t = 0 समय पर क्रियाकारक की प्रारंभिक सांद्रता [R]0 है t समय पश्चात इसकी सांद्रता [R] है।
अभिक्रिया वेग ∝ [R]
= – d[R]/dt = k[R]
यहाँ k प्रथम कोटि की अभिक्रिया का वेग स्थिरांक है। उपरोक्त समीकरण को प्रथम कोटि की अभिक्रिया का अवकल वेग समीकरण कहते है।
या
– d[R]/[R] = k dt
– (माइनस) से गुणा करने पर
d[R]/[R] = – k dt
समाकलन करने पर
∫d[R]/[R] = ∫ – k dt
ln [R] = -kt + I .. . . . . . . . . समीकरण 1
यहाँ I समाकलन नियतांक है इसका मान निम्न प्रकार से ज्ञात करते है।
यदि t = 0 है तो [R] = [R]0होगा।
अतः
समीकरण 1 से
ln [R] = -kt + ln [R]0
kt = ln [R]0 – ln [R]
kt = ln [R]0 / [R]
kt = 2.303 log [R]0 / [R]
k= (2.303/t ) log [R]0 / [R]
यह प्रथम कोटि की अभिक्रिया का समाकलित वेग समीकरण कहलाता है।
प्रथम कोटि की अभिक्रिया का अर्द्ध आयुकाल ज्ञात करना :
प्रथम कोटि की अभिक्रिया के लिए
k= (2.303/t ) log [R]0 / [R]
या
t= (2.303/k ) log [R]0 / [R]
यदि t = t1/2 है तो [R] = [R]0/2 होगा।
t1/2 = (2.303/k ) log ([R]0) / ([R]0/2)
t1/2 = (2.303/k ) log 2
चूँकि log 2 = 0.3010
log 2 का मान रखने पर
t1/2 = (2.303/k ) x 0.3010
t1/2 = 0.693 /k
अतः प्रथम कोटि की अभिक्रिया का अर्द्धकाल क्रियाकरको की प्रारंभिक सांद्रता पर निर्भर नहीं करता।
प्रश्न 1 : प्रथम कोटि की अभिक्रिया के लिए अर्द्ध आयुकाल ज्ञात करो यदि वेग स्थिरांक
(1) 200 sec-1
(2) 2 Min-1
(3) 4 Year-1
उत्तर : (1) t1/2 = 0.693 /k
t1/2 = 0.693 /2 x 10-2
t1/2 = 3.465 x 10-3 sec
(2) t1/2 = 0.693 /k
t1/2 = 0.693 /2
t1/2 = 3.465 x 10-1 Min
(3) t1/2 = 0.693 /k
t1/2 = 0.693 / 4
t1/2 = 1.732 x 10-1 Year
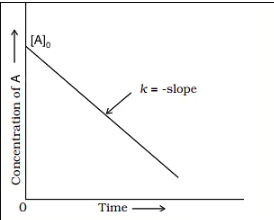
प्रथम कोटि की अभिक्रिया का आलेख निरूपण :
(1)प्रथम कोटि की अभिक्रिया के वेग समीकरण से
ln[R] = – kt + ln[R]0
y = -mx + c (अन्तः खण्ड)
(2)प्रथम कोटि की अभिक्रिया के वेग समीकरण से
kt = ln [R]0 / [R]
kt = 2.303 log [R]0 / [R]
log [R]0 / [R] = kt / 2.303
प्रश्न : प्रथम कोटि की अभिक्रिया का वेग स्थिरांक 60 sec-1 है। क्रियाकारक की प्रारंभिक सांद्रता से 1/16 भाग रह जाने में कितना समय लगता है।
उत्तर : t = (2.303/k) log [R]0 / [R]
दिया गया है
k = 60 sec-1
[R]0 = 1
[R] = 1/16
t = ?
t = (2.303/60) log 1 /(1/16 )
t = (2.303/60) log 16
t = 46.5 x 10-3
प्रथम कोटि की अभिक्रिया में 99% अभिक्रिया पूर्ण होने में लगा समय 90% अभिक्रिया पूर्ण होने में लगने वाले समय से दोगुना होता है , सिद्ध कीजिये।
उत्तर :
t99% पूर्ण होने में लगा समय
t = (2.303/k) log [R]0 / [R]
t99% = ?
[R]0 = 100
[R] = 1
t99% = (2.303/k) log 100
t99% = (2.303/k) x 2 [log 100 = 2 ]
t90% पूर्ण होने में लगा समय
t = (2.303/k) log [R]0 / [R]
t90% = ?
[R]0 = 100
[R] = 10
t90% = (2.303/k) log 100/10
t90% = (2.303/k) [log 10 = 1 ]
t99%/t90% = [(2.303/k) x 2] / (2.303/k)
t99%/t90% = 2
t99% = 2 x t90%
प्रथम कोटि की अभिक्रिया का समाकलित वेग समीकरण निम्न है
k = (2.303/t) log [R]0 / [R]
उपरोक्त समीकरण को निम्न प्रकार से भी व्यक्त कर सकते है।
माना t = 0 समय पर अर्थात प्रारम्भ में क्रिया कारकों की प्रारंभिक सांद्रता a molL-1 है। t समय पश्चात इसका x मोल वियोजित हो जाता है तो t समय पश्चात् इसकी शेष बची मात्रा (a – x) होगी अतः
[R]0 = a
[R] = (a – x)
k = (2.303/t) log a /(a – x)
प्रथम कोटि की अभिक्रिया के उदाहरण
(1) रेडियोएक्टिव पदार्थ का विघटन :
λ = (2.303/t)log(N0/Nt)
यहाँ λ = विघटन स्थिरांक
N0 = रेडियो ऐक्टिव तत्व की प्रारंभिक मात्रा
Nt = T समय पश्चात रेडियो सक्रिय तत्व की बची मात्रा
उदाहरण 2 : एथिल ऐसिटेट का अम्लीय माध्यम में जल अपघटन :
CH3COOC2H5 + H2O = C2H5OH + CH3COOH
अभिक्रिया वेग ∝ (CH3COOC2H5)(H2O)
उपरोक्त क्रिया में जल को अधिक मात्रा में लिया जाता है। क्रिया के बाद जल की सांद्रता में कोई मापने योग्य परिवर्तन नहीं होता अतः जल की सान्द्रता को स्थिर मान सकते है।
अतः
अभिक्रिया वेग ∝ (CH3COOC2H5)
उपरोक्त समीकरण से स्पष्ट है की अभिक्रिया वेग ऐथिल ऐसिटेट की सांद्रता के प्रथम धातु के समानुपाती है अतः यह प्रथम कोटि की अभिक्रिया है।
नोट : इस अभिक्रिया की कोटि एक तथा अणुसंख्यता या आणविकता दो है अतः इसे छदम प्रथम कोटि या छ्दम एकाणुकता अभिक्रिया कहते है।
उदाहरण : C12H22O11(sucrose) + H2O = C6H12O6 (glucose) + C6H12O6(fructose)
उपरोक्त अभिक्रिया कोटि एक व आणविकता दो होगा अतः यह छदम एकाणु अभिक्रिया है।
प्रोयोगिक वेग ∝ (C12H22O11)